
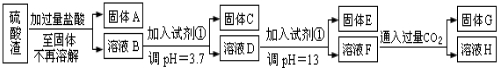
分析 硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸(过量);向溶液B中加试剂①并调节溶液的pH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的pH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝.
(1)固体A为难溶于盐酸的二氧化硅;
(2)分离得到固体和溶液的实验操作是过滤,将沉淀转化为相应的稳定的氧化物,需灼烧(加热);
(3)试剂①是强碱溶液;
(4)溶液F中通入过量CO2,NaAlO2溶液和过量的CO2反应生成氢氧化铝和碳酸氢钠;
(5)根据氢氧化镁Ksp=5.6×10-12来计算.
解答 解:(1)硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,化学式为:SiO2,
故答案为:SiO2;
(2)分离得到固体和溶液的实验操作是过滤,固体C是氢氧化铁,固体E是氢氧化镁,固体G是氢氧化铝,加热均可分解得到对应的氧化物,
故答案为:过滤 灼烧(加热);
(3)试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,
故选:A;
(4)NaAlO2溶液中通入过量的CO2反应生成氢氧化铝和碳酸氢钠,离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3+2 HCO3-;
(5)因溶液的pH值为13,c(OH-)=10-1mol•L-1,Ksp=c(Mg2+)×c2(OH-)=c(Mg2+)×10-2=5.6×10-12,所以c(Mg2+)=5.6×10-10 mol•L-1,
故答案为:5.6×10-10.
点评 本题考查了物质的分离、提纯的方法选择及应用,题目难度中等,明确各物质的性质是解本题的关键,本题注意溶度积的相关计算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
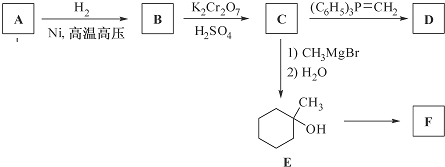

 $\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$
$\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$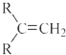 (R表示烃基,R′和R″表示烃基或氢)
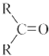
(R表示烃基,R′和R″表示烃基或氢) 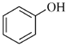 .写出A中含氧官能团的名称:羟基
.写出A中含氧官能团的名称:羟基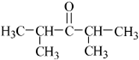 或
或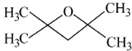 .(不考虑环状结构)
.(不考虑环状结构)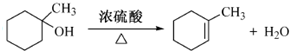 .
.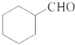 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示)
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示)查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2为V形的极性分子 | |
| B. | SO2与O3互为等电子体 | |
| C. | NaCl的晶格能高于KCl | |
| D. | 第一电离能由高到低的顺序为:F>O>N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$
,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$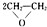 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com