
分析 根据热化学方程式中焓变的意义以及热化学方程式的书写方法来回答;NaHCO3水解溶液呈碱性,Al2(SO4)3在溶液中水解显酸性,二者混合发生相互促进的水解,生成二氧化碳和氢氧化铝.
解答 解:1gC2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,则1mol乙醇燃烧放出的热量=$\frac{29.7kJ}{\frac{1g}{46g/mol}}$=1366.7kJ,所以其热化学反应方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.7kJ/mol,HCO3-水解,反应为:HCO3-+H2O?H2CO3+OH-,溶液呈碱性;
NaHCO3水解溶液呈碱性,Al2(SO4)3在溶液中水解显酸性,NaHCO3溶液跟Al2(SO4)3溶液混合,发生相互促进的水解:3HCO3-+Al3+=3CO2↑+Al(OH)3↓,产生大量的气体和沉淀,
故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.7kJ/mol;Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评 本题考查了热化学方程式的书写、盐的水解等知识,侧重于基础知识的考查,题目难度不大,注意把握盐类水解的实质和应用.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 5 | C. | 6 | D. | 多于6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | Na2CO3可与盐酸反应 | 碳酸钠溶液可用于治疗胃酸过多 | Ⅰ对,Ⅱ对,有 |
| B | Cl2使鲜艳的红色花瓣褪色 | Cl2具有漂白性 | Ⅰ对,Ⅱ对,有 |
| C | 铝制饮具最好不要盛放酸性或碱性 较强的液体食物 | 因为Al和Al2O3既可以与酸反应, 又可以与碱反应 | Ⅰ对,Ⅱ对,无 |
| D | Na2O2能和CO2、H2O反应生成O2 | 过氧化钠可用作航天员的供氧剂 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用pH试纸测定溶液pH时若先润湿,测得溶液的pH一定有影响 | |
| B. | 25℃时,水溶液中水电离出的c(H+)和水电离的c(OH-)乘积一定等于10-14 | |
| C. | 如果Na2Y的水溶液显中性,该溶液中一定没有电离平衡 | |
| D. | 温度保持不变,向水中加入醋酸钠固体一定会影响水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,4.6g NO2和N2O4混合气体中含有的N原子数目为0.1NA | |
| B. | 25℃时,pH=12的Ba(OH)2溶液中含有的OH-数目为0.01NA | |
| C. | 1L 0.1mol•L-1 K2CO3溶液中,阴离子数目大于0.1NA | |
| D. | 2molSO2和1molO2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
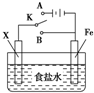
| A. | 若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 | |
| B. | 若 X 为锌棒,开关 K 置于 A 或 B 处均可减缓铁的腐蚀 | |
| C. | 若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| D. | 若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到铁棒附近先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
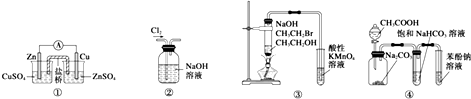
| A. | 装置①:构成锌-铜原电池 | |
| B. | 装置②:除去Cl2中含有的少量HCl | |
| C. | 装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH | |
| D. | 装置③:验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com