
【题目】设NA为阿伏加德罗常数的数值,完成下列填空:
(1)1molCH4含原子个数为________;34g H2O2所含分子数目为________。
(2)标准状况下,0.5NA个CO分子所占有的体积为________L。
(3)标准状况下,33.6LH2和CH4的混合气体所含的分子数目为________。
【答案】5NA NA11.2L1.5 NA
【解析】
本题考查物质的量和阿伏加德罗常数的关系。即1mol=1NA, 每个甲烷分子中含有1个碳原子和4个氢原子,所以1molCH4含原子个数为5NA; 标准状况下,1mol任何气体的体积约为22.4L。以此分析解答本题。
(1)每个甲烷分子中含有1个碳原子和4个氢原子,所以1molCH4含原子个数为5NA;34gH2O2的物质的量n=34g/34g.mol-1=1mol,故所含分子数目为NA;答案为:5NA 、NA
(2)标准状况下,CO为气体,0.5NA个CO分子的物质的量为0.5mol,所占有的体积V=nVm=10.5mol![]() 22.4L/mol=1.2L。答案为11.2L。
22.4L/mol=1.2L。答案为11.2L。
(3)标准状况下,33.6LH2和CH4的混合气体的物质的量n=33.6L/22.4L.mol-1=1.5mol,所含的分子数目为1.5NA。答案为1.5NA


科目:高中化学 来源: 题型:
【题目】芳香化合物在催化剂催化下与卤代烃发生取代反应称为Friedel-Crafts烷基化反应。某科研小组以苯和氯代叔丁烷[ClC(CH3)3]为反应物,无水AlCl3为催化剂条件下制备叔丁基苯(![]() )。反应如下:
)。反应如下:
![]() 。
。
已知:
(1)AlCl3:熔点:190 C,沸点:180 C,遇水极易潮解并产生白色烟雾,微溶于苯。
(2)苯:M=78g/mol,ρ:0.88g/cm3,沸点:80.1 C,难溶于水,易溶于乙醇。
(3)氯代叔丁烷M=92.5g/mol,ρ:1.84g/cm3,沸点:51.6 C,难溶于水,可溶于苯。
(4)叔丁基苯:M=134g/mol,ρ:0.87g/cm3,沸点:169 C,难溶于水,易溶于苯。
I、如图是实验室制备无水AlCl3的实验装置:
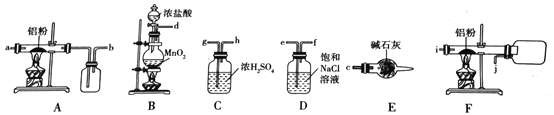
(1)选择合适的装置制备无水AlCl3正确的连接顺序为:_____________________(写导管口标号)。
(2)写出B装置中发生反应的离子方程式:______________。
(3)能否将E装置替换成C装置:______(填“能”或“不能”)理由:__________。
II、实验室制取叔丁基苯装置如图:

在三颈烧瓶中加入50mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷[ClC(CH3)3]10mL,一定温度下反应一段时间,将反应后的混合物依次用稀盐酸、5%Na2CO3溶液、H2O洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20g。
(4)仪器A的名称为_______,B中试剂是碱石灰,其作用是_____________________,使用恒压漏斗的优点是__________________________。
(5)用H2O洗涤的目的是______________,加无水MgSO4固体的作用是______________。
(6)叔丁基苯的产率为____________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组对乙醇的分子结构进行探究,其过程如下:
猜想一:乙醇的结构简式是CH3CH2OH
猜想二:乙醇的结构简式是CH3OCH3
制定方案并实施:按下图所示实验装置进行实验,

测定乙醇与钠反应(放热)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目。
试回答下列问题:
(1)指出实验装置中的错误 。
(2)如果实验装置和操作正确,且结论符合猜想一,则参加反应的乙醇的物质的量与产生氢气的物质的量之比可能为 。
(3)如果实验装置和操作正确,且结论符合猜想二,则参加反应的乙醇的物质的量与产生氢气的物质的量之比可能为 。
(4)如果实验装置正确,实验结果为2.3 g乙醇与足量金属钠反应时产生了标准状况下的氢气约0.56 L,则乙醇的结构简式应为 ,理由是 。
(5)该实验获得成功的关键,除了需要纠正图中的装置错误以外,还需注意下列问题中的 (用序号填写)。
①装置的气密性良好;
②实验开始前准确测定乙醇的量;
③钠足量;
④广口瓶中水的体积大于560 mL;
⑤氢气的体积测算准确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组物质中,找出合适的序号填在对应的空格内:
①NO2和N2O4 ②12C和14C ③40 19K和40 20Ca
④异戊烷( )
)
和新戊烷( )
)
⑤ 和
和 ⑥甲烷和丙烷
⑥甲烷和丙烷
(1)互为同位素的是________。
(2)互为同分异构体的是________。
(3)互为同系物的是________。
(4)为同一种物质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃在标准状况下密度为2.59 g·L-1。
(1)其相对分子质量等于________。
(2)该烃的含碳量为82.8%,则分子中碳、氢原子的个数比是________,分子式是________。
(3)可能的结构简式及名称是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y均得1个电子达到8e﹣的稳定结构,且X得电子放出的能量大于Y得电子放出的能量,则下列说法不正确的是( )
A.X,Y同主族
B.X原子的半径大于Y原子的半径
C.X的非金属性强于Y的非金属性
D.X﹣的还原性弱于Y﹣的还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________;K、F、Zn的电负性从大到小的顺序为___________。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________。
(3)OF2分子的几何构型为___________(1分),中心原子的杂化类型为___________。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3中除σ键外,还存在___________。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为___________个。
②该晶体的密度为___________(列出算式即可,用NA表示阿伏加德罗常数的数值)g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com