


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
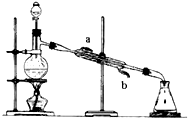 如图所示的仪器装置,在实验室合成乙酸乙酯的粗产品.在蒸馏烧瓶内将过量的乙醇与适量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏.得到含有乙醇、醋酸和水的乙酸乙酯粗产品.
如图所示的仪器装置,在实验室合成乙酸乙酯的粗产品.在蒸馏烧瓶内将过量的乙醇与适量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏.得到含有乙醇、醋酸和水的乙酸乙酯粗产品.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
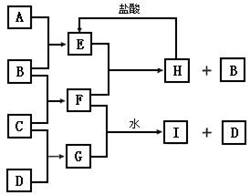
| A | B | C | D | E | |
| C | ↓ | ↓ | - | ↑ | - |
| B | ↓ | - | ↓ | - | - |
| A、HCl |
| B、Ca(HCO3)2 |
| C、Na2CO3 |
| D、Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铝制饮具最好不要盛放酸性或碱性较强的液体食物 | 因为Al和Al2O3既可以与酸反应,又可以与碱反应 | Ⅰ对,Ⅱ对,无 |
| B | 氯气不能使干燥的有色布条褪色,能使湿润的有色布褪色 | 说明次氯酸的氧化性比氯气强 | Ⅰ对,Ⅱ对,无 |
| C | 二氧化硫能使KMnO4溶液褪色 | 二氧化硫具有漂白性 | Ⅰ对,Ⅱ对,无 |
| D | 常温下,铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸 | 因为铁和铝与浓硫酸或浓硝酸发生钝化. | Ⅰ对,Ⅱ对,有 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molH2、1molCO | 1mol CH3OH | 4molH2、2molCO |
| 平衡时n(CH3OH ) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为了减肥,我每天只吃水果、蔬菜 |
| B、食用海产品可防治缺铁性贫血 |
| C、选择食物可调节人体细胞中的酸碱平衡 |
| D、我国应该禁止使用食物防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com