
【题目】某学生用标准的0.2mol/L的盐酸滴定待测的NaOH溶液,其实验操作如下:A.用碱式滴定管取待测液NaOH溶液放入锥形瓶,滴加2﹣3滴酚酞指示剂.
B.用待测的NaOH溶液润洗碱式滴定管.
C.检查滴定管是否漏水.
D.取下酸式滴定管,用标准的盐酸溶液润洗后,再将标准的盐酸注入酸式滴定管至刻度“0”以上2cm﹣3cm处,把酸式滴定管固定好,调节液面.
E.把滴定管用蒸镏水洗净,并分别固定在滴定管架两边.
F.另取锥形瓶,再重复滴定操作一次.
G.把锥形瓶放在酸式滴定管的下面,瓶下垫一张白纸,然后边滴定边摇动锥形瓶,直至终点,记下滴定管的液面所在刻度.
据上述滴定操作,完成下列填空:
(1)滴定操作的正确操作顺序是(用上述各编号字母填写)→E→→B→→→;
(2)G步操作中判断滴定终点的依据是;
(3)D步骤的操作中液面应调节到 , 尖嘴部分应;
(4)酸式滴定管未用标准的盐酸润洗,待测溶液NaOH的测定值会;碱式滴定管未用待测的NaOH溶液润洗,待测NaOH溶液的测定值会 . (填“偏高”、“偏低”或“无影响”.)
【答案】
(1)C;D;A;G;F
(2)当滴加最后一滴盐酸时,溶液由红色变为无色,且半分钟内不褪色
(3)0或0刻度以下某一刻度;充满液体
(4)偏高;偏低
【解析】解:(1)操作的步骤是选择滴定管检漏(C),然后洗涤(E)、装液(D)、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数.用待测的NaOH溶液润洗碱式滴定管(B).再取待测液于锥形瓶(A),然后加入指示剂进行滴定(G),另取锥形瓶,再重复滴定操作一次(F),所以顺序为:C→E→D→B→A→G→F,故答案为:C;D;A;G;F;(2)本实验是用盐酸滴定NaOH溶液,用酚酞作指示剂,所以终点时,现象是当滴加最后一滴盐酸时,溶液由红色变为无色,且半分钟内不褪色,故答案为:当滴加最后一滴盐酸时,溶液由红色变为无色,且半分钟内不褪色;(3)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡,故答案为:0或0刻度一下某一刻度;充满液体;(4)酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,盐酸被稀释,浓度降低,造成V(标准)偏大,根据c(待测)= ![]() 分析可知c(待测)偏高,碱式滴定管未用待测的NaOH溶液润洗,待测NaOH溶液被稀释,造成V(待测)偏大,根据c(待测)=
分析可知c(待测)偏高,碱式滴定管未用待测的NaOH溶液润洗,待测NaOH溶液被稀释,造成V(待测)偏大,根据c(待测)= ![]() 分析可知c(待测)偏低,故答案为:偏高;偏低. (1)中和滴定有检漏、洗涤、润洗、装液、取待测液于锥形瓶,然后加入指示剂进行滴定等操作;(2)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;(3)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡;(4)根据c(待测)=
分析可知c(待测)偏低,故答案为:偏高;偏低. (1)中和滴定有检漏、洗涤、润洗、装液、取待测液于锥形瓶,然后加入指示剂进行滴定等操作;(2)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;(3)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡;(4)根据c(待测)= ![]() 分析不当操作对V(标准)的影响,以此判断浓度的误差.
分析不当操作对V(标准)的影响,以此判断浓度的误差.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】核内中子数为N的R2+的离子,质量数为A,则n g它的氧化物中所含质子的物质的量为
A. [Failed to download image : http://qbm-images.oss-cn-hangzhou.aliyuncs.com/QBM/2016/4/21/1576400823083008/1576400823451648/STEM/4f7c26b99e6a42c7aaf4841443351601.png](A-N+8) mol B. [Failed to download image : http://qbm-images.oss-cn-hangzhou.aliyuncs.com/QBM/2016/4/21/1576400823083008/1576400823451648/STEM/4f7c26b99e6a42c7aaf4841443351601.png](A-N +10)mol
C. (A-N+2) mol D. [Failed to download image : http://qbm-images.oss-cn-hangzhou.aliyuncs.com/QBM/2016/4/21/1576400823083008/1576400823451648/STEM/a40f7327e87d449c82667a487f0fe433.png](A-N +6) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的物质之间的转化关系如下图所示.其中,A为两种元素组成的化合物,反应①中生成C、D物质的量之比为3:4,D是不溶于水的白色固体,除反应③⑤外其他反应均在溶液中进行,F、G是气态非金属单质,K是一种常见的非极性有机溶剂,密度比水大.(某些生成物和反应条件已略去)
(1)反应③的类型为;
(2)A的化学式是;K的电子式;
(3)写出①反应的化学方程式:;
(4)组成F的元素在元素周期表中的位置是;
(5)E中金属阳离子的检验方法;
(6)写出反应⑦的离子方程式:;
(7)用离子方程式表示H溶液显碱性的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①为纪念著名天文学家哥白尼,国际纯粹与应用化学联合会将112号元素的符号定为“Cn”,汉语名为“![]() ”;②合理利用核能符合“低碳经济”的要求, 92U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6,还含有FeO、MgO、CaO等杂质)。下列有关叙述对上述所涉及元素的说法正确的是
”;②合理利用核能符合“低碳经济”的要求, 92U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6,还含有FeO、MgO、CaO等杂质)。下列有关叙述对上述所涉及元素的说法正确的是
A. ![]() Cn的原子核内中子数与核外电子数之差为55
Cn的原子核内中子数与核外电子数之差为55
B. 92U和92U是同位素,核反应属于化学变化
C. 40Ca2+与18O2具有相同的电子数
D. Si2O![]() 中电子总数为80
中电子总数为80
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表所示:
实验编号 | HA物质的量浓度(mol*L﹣1) | NaOH物质的量浓度(mol*L﹣1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组情况表明,HA是(填“强酸”或“弱酸”).
(2)②组情况表明,c0.2(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A﹣)与c(Na+)的大小关系是 .
(3)从③组实验结果分析,说明HA的电离程度NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是 .
(4)①组实验所得混合溶液中由水电离出的c(OH﹣)与溶液中的c(OH﹣)之比为 . 写出该混合溶液中下列算式的精确结果(不能近似计算):c(Na+)﹣c(A﹣)=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
W | X | Y | Z | |
结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于族.
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是(填序号).a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因: .
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是 , 混合后溶液中离子浓度由大到小的顺序是 .
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.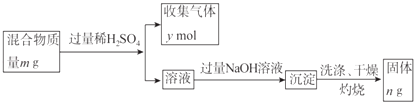
能确定混合物中Y的质量分数的数据有(填序号).
a.m、n b.m、y c.n、y.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验仪器的使用或实验方法正确的是( )
A.加入少量浓盐酸,在加热条件下除去试管内壁上沾有的MnO2
B.烧杯、滴定管用蒸馏水洗涤干净,烘箱烘干后备用
C.淀粉溶液在酸性条件下加热后,再加入新制Cu(OH)2检验淀粉是否水解
D.实验室制备乙酸乙酯时,用饱和NaOH溶液吸收乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有化合物X,Y,Z,W,其焰色反应均为紫色.它们按下列反应式转化: ①X+Ca(OH)2→Y+CaCO3↓
②W ![]() X+CO2↑+H2O
X+CO2↑+H2O
③Z+CO2→X+O2
④Z+H2O→Y+O2↑
则X,Y,Z,W依次是( )
A.KCl、KOH,K2CO3、KHCO3
B.K2CO3、KOH,K2O2、KHCO3
C.K2SO3、KOH,K2O2、KHCO3
D.KHCO3、KOH,K2O2、K2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于容量瓶及其使用方法的叙述,正确的是
①是配制一定物质的量的浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液 ③容量瓶可以用来加热
④不能用容量瓶贮存配制好的溶液 ⑤可以用400mL容量瓶配制250mL溶液
A. ①和② B. ①和④ C. 除了③ D. 除了③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com