
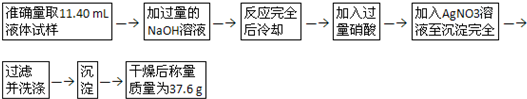
| m |
| M |
| m |
| M |
| m |
| M |
| 37.6g |
| 188g/mol |
| m |
| M |
| 18.8g |
| 188g/mol |


科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加入过量A |
| 加入过量B |
| 过滤 |
| 加入适量C |
| 加热煮熟 |
| 目的 | 离子方程式 | |
| 加入过量A | ||
| 加入过量B | ||
| 加热煮沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池中失去电子的电极为正极 |
| B、在原电池的负极和电解池的阳极上都发生氧化反应 |
| C、原电池是将氧化还原反应产生的化学能转化为电能的一种装置 |
| D、电解的过程就是将电能转化为化学能的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com