
A.氢氧化铝胶体;
B.食盐水;
C.铜;
D.硝酸;
E.烧碱;
F.蔗糖;
G.泥水;
H.一氧化碳;
I.CuSO4·5H2O晶体;
J.SO2;
K.HCl 气体;
L.CaO固体;
M.食醋(含醋酸的溶液)
(1)下列物质中属于电解质的是 (填序号,下同);属于非电解质的是 。
(2)上述的酸性氧化物与氢氧化钠反应的化学方程式为 ,上述的碱性氧化物与盐酸反应的化学方程式为 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年福建省高一上学期期中化学试卷(解析版) 题型:选择题
下列萃取与分液结合进行的操作(用CCl4为萃取剂从碘水中萃取碘)中错误的是( )
A. 饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用左手压住分液漏斗上口部,右手握住活塞部分,把分液漏斗倒转过来振荡
B. 静置,分液漏斗中溶液分层,下层呈紫红色,上层几乎无色
C. 打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出
D. 最后继续打开活塞用另一个烧杯承接上层液体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
α1和α2,c1和c2分别为两个恒容容器中平衡体系N2O4(g) 2NO2(g)和3O2(g)
2NO2(g)和3O2(g) 2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
A.α1、α2均减小,c1、c2均增大
B.α1、α2均增大,c1、c2均减小
C.α1减小,α2增大,c1、c2均增大
D.α1减小,α2增大,c1增大,c2减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.增大反应物浓度可以增大活化分子百分数,从而使反应速率增大
B.汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能
C.常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0
D.在“中和热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即 盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度
盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五县七校高一上期中化学试卷(解析版) 题型:计算题
硫酸和盐酸组成的混合液100.0 mL,向其中加入氢氧化钡粉末4.275g,充分反应后,经过滤、洗涤、干燥,得到沉淀2.330g,同时测得滤液中的OH-离子浓度为0.100 mol·L-1 。(设溶液总体积始终不变)请列式计算
mL,向其中加入氢氧化钡粉末4.275g,充分反应后,经过滤、洗涤、干燥,得到沉淀2.330g,同时测得滤液中的OH-离子浓度为0.100 mol·L-1 。(设溶液总体积始终不变)请列式计算
(1)原溶液中硫酸的物质的量为____________。
(2)原混合液中盐酸的物质的量浓度_______________。
(3)若将原硫酸和盐酸混合溶液100ml与足量金属锌反应,则在标况下产生的气体体积为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五县七校高一上期中化学试卷(解析版) 题型:选择题
已知3.0g AO32- 中核外电子数比质子数多6.02×1022个,下列说法中正确的是
A.A元素的相对原子质量为12
B.AO32-的摩尔质量为60
C.3.0gAO32- 的物质的量是0.02mol
D.A原子的摩尔质量32g/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五县七校高一上期中化学试卷(解析版) 题型:选择题
实验室实验时也可用推拉注射器活塞的方法检查图中装置的气密性。当向外拉活塞时,如果装置气密性良好,可能观察到
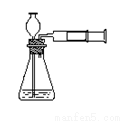
A. 瓶中液面明显上升 B. 长颈漏斗下端口产生气泡
C. 长颈漏斗内的液面上升 D. 注射器内有液体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五县七校高二上期中化学试卷(解析版) 题型:填空题
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用ClO2氧化氮氧化物反应过程如下:
NO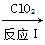 NO2
NO2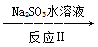 无污染物
无污染物
反应Ⅰ的化学方程式是2NO+ClO2+H2O=NO2+HNO3+HCl,反应Ⅱ的化学方程式是__________________________。
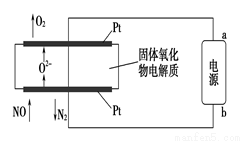
(2)利用固体氧化物电解池通过电解方式分解氮氧化物的过程如图3所示,写出电解池中通入NO一端的电极反应式:_______________________。
(3)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
①则NO2 与SO2反应的热化学方程式为______________________。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_____________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
e.混合气体的平均分子量不再变化
③测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡时NO2的转化率=____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济宁市历城区高二上期中化学试卷(解析版) 题型:选择题
下表中是各组反应的反应物和反应温度,反应刚开始时放出H2速率最快的是( )
编号 | 金属(粉末状) | 酸的浓度及体积 | 反应温度 |
A | Mg,0.1 mol | 6mol·L-1 硝酸10mL | 60℃ |
B | Mg,0.1 mol | 3mol·L-1 盐酸10mL | 60℃ |
C | Fe,0.1 mol | 3mol·L-1L盐酸10mL | 60℃ |
D | Mg,0.1 mol | 3mol·L-1 硫酸10mL | 60℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com