
【题目】CO2和H2的混和气体加热到1023K时,可建立下列平衡:CO2+H2![]() CO+H2O(g),在该温度下,平衡时有90%的氢气变成水蒸气(平衡常数K=1),则原混合气体中CO2和H2的分子数之比是( )
CO+H2O(g),在该温度下,平衡时有90%的氢气变成水蒸气(平衡常数K=1),则原混合气体中CO2和H2的分子数之比是( )
A. 9:1 B. 1:5 C. 1:10 D. 1:1
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”可延长鲜花的寿命。右表是1 L“鲜花保鲜剂”的成分(其中阿司匹林不含K+ ,其存在也不会干扰成分中其他离子的检验),回答下列问题:
成分 | 质量/g | 摩尔质量/(g·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是_____________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为________________ mol·L-1。(只要求写表达式,不用化简,不需计算)。
(3)下图所示的仪器中,在配制一定量浓度的“鲜花保鲜剂”溶液时肯定不需要的是________(填字母),还缺少的玻璃仪器有_______________(填仪器名称)。
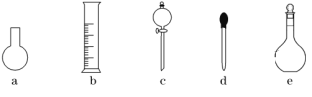
(4)市面上,有一种营养液可用于无土栽培,该营养液中有KCl和K2SO4,其中K+的浓度为0.5mol/L,Cl-的浓度为0.1mol/L,则100mL该营养液中n(SO42-)=_______ mol。
(5)欲检验“鲜花保鲜剂”中的硫酸根离子,步骤是:取少量鲜花保鲜剂于试管中,滴加足量的盐酸后,再滴加___________溶液,看到______________,证明有硫酸根离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将定量的Na2CO3和NaHCO3的混合物加热到不再放出气体时,收集到CO2aL,冷却后向残余物中加入足量盐酸又收集到CO2 2 aL (体积均在标准状况下测定)。则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素[CO(NH3)2]
已知:①2NH3(g)+CO2(g)=NH2CO2NH4 (s) △H=-159.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③H2O(l)=H2O(g) △H=+44 kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为______________。
(2)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H
N2(g)+CO2(g)+2H2O(g) △H
在温度为T1和T2时,分别将0.40molCH4和1.0molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如右图所示:
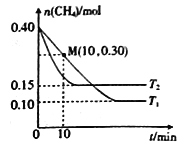
①根据右图判断该反应的△H________0(填“>”、“<”或“=”),理由是______________。
②温度为T1时,0~10min内NO2的平均反应速率v(NO2)=__________,反应的平衡常数K=___(保留三位小数)
③该反应达到平衡后,为在提高反应速率同时提高NO2的转化率,可采取的措施有______(填标号)。
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为________;常温下,将amol·L-1 的HN3与bmol·L-1 的Ba(OH) 2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该混合物溶液呈_______(填“酸”、“碱”或“中”)性,溶液中c(HN3)=_________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题。
(1)N原子核外有___种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为___________。
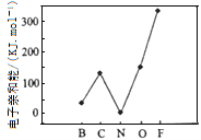
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_______________________;氮元素的E1呈现异常的原因是_______________________。
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为___________________。
(4)铵盐大多不稳定。NH4F、NH4I中,较易分解的是____,原因是__________________。
(5)第二周期中,第一电离能介于B元素和N元素间的元素为_____(填“元素符号”)。
(6)已知:①NO2 + CO ![]() CO2 + NO
CO2 + NO
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是
A. 标准状况下,22.4LH2O含有的分子数为 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 同温、同压下,相同体积的任何气体,所含分子数和原子数都相同
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下图判断,下列叙述正确的是( )

A. 图Ⅲ盐桥的原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
B. Ⅰ和Ⅱ中负极反应均是Fe-2e-===Fe2+
C. Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-===4OH-
D. Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,Ⅱ有蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日天津港危险品仓库发生的爆炸事故,再次警示人们在注重提高科技化工发展水平的同时,不可忽视化学试剂存放的基本问题。下列在实验室中关于试剂存放叙述正确的是

A. 白磷不易挥发,不需要密闭存放;
B. 氰化物的包装标签上应贴上如图所示的标志
C. 氢氧化钠溶液应保存在带玻璃塞的细口试剂瓶中
D. 用容量瓶配制好溶液进行贮存时,需在容量瓶上贴上浓度标签
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.光导纤维是以二氧化硅为主要原料制成的
B.二氧化硅溶于水生成硅酸
C.石英、水晶、玛瑙的主要成分都是二氧化硅
D.二氧化硅是一种熔沸点很高、硬度很大的氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com