
【题目】已知:①C(s、金刚石) + O2(g)=CO2(g) ΔH1=-395.4 kJmol-1,② C(s、石墨) + O2(g)=CO2(g) ΔH2=-393.5 kJmol-1 上述反应中的能量变化如图所示,下列说法正确的是

A.石墨和金刚石之间的转化是物理变化
B.图中 b 代表反应①的能量变化
C.C(s、金刚石) =C(s、石墨) ΔH= +1.9 kJmol-1
D.金刚石比石墨的热稳定性好
科目:高中化学 来源: 题型:
【题目】2017年5月9日,我国科学技术名词审定委员会等单位正式发布115号等4种人工合成的新元素的名称、元素符号,115号元素名称为“镆”,符号为Mc。下列有关说法正确的是
A.Mc的最低负化合价为-3B.Mc的最高价氧化物的化式为Mc2O 5
C.![]() 的中子数为115D.通过化学反应可使
的中子数为115D.通过化学反应可使![]() 转化为
转化为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示,整辆“纳米车”的对角线的长度仅为3至4纳米),每 辆“纳米车”是由一个有机分子和四个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法不正确的是

A.人们用肉眼看不到“纳米车”的运动
B.“纳米车”的诞生说明人类操纵分子的技术进入了一个新阶段
C.C60是一种新型的化合物
D.C60的摩尔质量为720gmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有广泛的应用,回答下列问题。
(1)实验室中常用浓盐酸和二氧化猛混合加热制备氯气,下列反应中盐酸所体现的性质与该反应相同的是________
a.Zn+2HCl=ZnCl2+H2↑
b.KClO3+6HCl=KCl+3Cl2↑+3H2O
c.2HCl![]() H2↑+Cl2↑
H2↑+Cl2↑
d.2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
(2)向硫酸酸化的髙锰酸钾溶液中滴加H2O2溶液,高锰酸钾备液褪色并有气泡冒出,该反应中氧化剂与还原剂的物质的量之比为______,若生成标准状况下3.36 L气体时转移的电子数为________。
(3)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝生产加工过程中产生大量的铝灰,直接掩埋造成铝资源浪费,还会带来严重的污染。某铝厂的铝灰经分析所含主要物质如下:Al、Al2O3、AlN、SiO2、Fe2O3,其他杂质均不溶于稀硫酸。如图是酸浸法用该铝灰生产高纯氧化铝的生产流程:
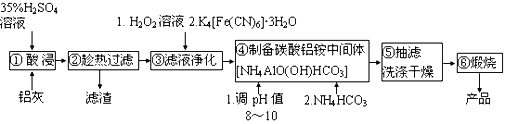
已知:i.Fe3+ +K++ [Fe(CN)6]4-=K[Fe(CN)6Fe]↓
ii.AlN常温下与水缓慢反应,酸性或碱性条件下反应较快
iii.NH4AlO(OH)HCO3难溶于碱性溶液和乙醇
请回答:
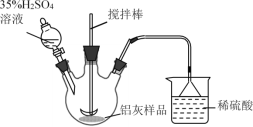
(1)实验室模拟工业生产①酸浸步骤的装置如图,该装置的不合理之处为____。
(2)步骤③加入H2O2溶液的目的是________________。
(3)步骤④调节pH最合适的试剂是________________。
A.NaOH B.H2SO4 C.NH3·H2O D.Ca(OH)2
(4)步骤⑤吸滤瓶内液体高度快达到支管口位置时应拔掉瓶上橡皮管,_______,洗涤沉淀操作为_______________。
(5)写出煅烧碳酸铝铵中间体得到高纯氧化铝的化学方程式______________。
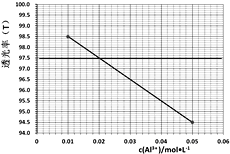
(6)已知Al3+对光的吸收与其浓度成线性关系,色度计传感器可以测量某种波长的光穿过溶液的透射率确定溶液浓度。如图是红色光照下透光率(T)对应c(Al3+)的标准曲线。为测定铝灰中铝元素的回收率,准确称取0.5000g铝灰(折合铝元素含量60.00%)进行制备高纯氧化铝的实验,将所制得的粉末与固体NaOH反应后加水溶解、过滤,滤液定容到250mL容量瓶中。用移液管移取25.00mL到锥形瓶中,加2滴指示剂,滴加稀盐酸至溶液体积变为50.00mL,NaAlO2恰好反应生成AlCl3。取该溶液于比色皿中进行色度检测,测得溶液透光率为97.5,则铝元素的回收率=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。

t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.
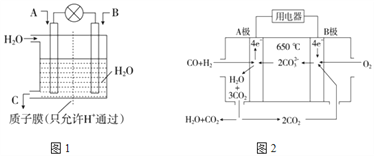
(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图1所示:
①若A为CO,B为H2,C为CH3OH,则通入CO的为_________极(填“正”或“负”)。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:___________________________。
(2)碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接做燃料,其工作原理如图2所示。
①电池总反应为____________________________________________。
②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6g,电解后溶液体积为2L,溶液的pH约为___________。
(3)某研究小组利用下列装置用N2O4生产新型硝化剂N2O5。
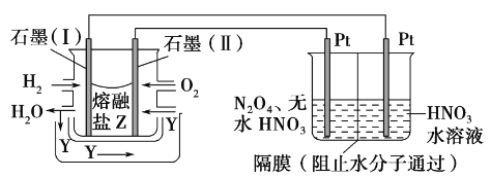
①现以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。在该电极上同时还引入CO2的目的是__________________________。
②电解过程中,生成N2O5的电极反应方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可通过煤的液化合成甲醇,主反应为:CO(g)+2H2(g)=CH3OH(l) △H=x
(1)己知常温下CH3OH、H2和CO的燃烧热分別为726.5kl/mo1、285.5kJ/mol、283.0kJ/mol,則x=_______;为提高合成甲醇反应的选择性,关键因素是___________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应(CH3OH为气体),相关数据如图。

①该反应0-10min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是______(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为_______。相同条件下,若起始投料加倍,达平衡时,CO的体积分数将________(填“增大”、“减小”或“不变”)
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)表示平衡常数(以Kp表示),其中,PB=P总×B的体积分数;若在TK下平衡气体总压强xatm,则该反应Kp=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K的自然对数)如图,请分析lnK随T呈现上述变化趋势的原因是:____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有![]() 、OH-、
、OH-、![]() 、
、![]() 、[Al(OH)4] -、
、[Al(OH)4] -、![]() 、Na+、Mg2+、Fe3+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示。下列说法正确的是
、Na+、Mg2+、Fe3+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示。下列说法正确的是
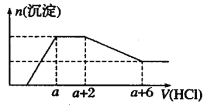
A.原溶液中一定含有Na2SO4
B.原溶液中含有![]() 与[Al(OH)4] -的物质的量之比为1 :2
与[Al(OH)4] -的物质的量之比为1 :2
C.反应最后形成的溶液中的溶质只有NaCl
D.原溶液中一定含有的阴离子是OH-、![]() 、
、![]() 、[Al(OH)4] -
、[Al(OH)4] -
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com