
某工厂排出的废水中含有大量的Fe2+、Cu2+和SO![]() .为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁.
.为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁.
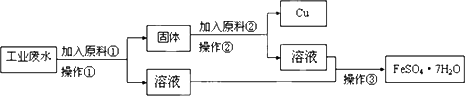
请回答:
(1)原料①为________.
(2)写出加入原料②后反应的离子方程式:________.
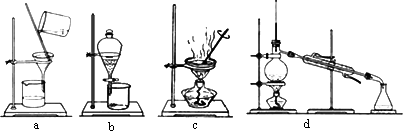
(3)该流程若在实验室中完成,操作②需要用到的玻璃仪器的名称是________;操作③需要用到的下列实验装置是________(填字母).
科目:高中化学 来源:导学大课堂必修二化学人教版 人教版 题型:038
某工厂排出的废水中含Cl2,为除去废水中的游离氯,并使废水变成中性,采用如图所示的方案处理废水,在A、B处分别注入一定流量的废烧碱溶液和亚硫酸钠溶液处理.
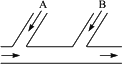
(1)请写出所发生反应的化学方程式,指出氯气在反应中的作用是否相同.
(2)试写出A、B处应加入处理液的化学式分别是________、________,并说明原因.
查看答案和解析>>
科目:高中化学 来源:高考三人行 化学 题型:043
某工厂排出的废水中含Cl2,为除去废水中的游离氯,而且使废水变成中性,如果采用如图所示的方案处理废水,在A、B处分别注入一定流量的废烧碱溶液和亚硫酸钠溶液处理.
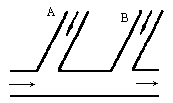
(1)请写出所发生反应的化学方程式,指出氯气在反应中的作用是否相同.
(2)试写出A、B处应加入处理液的化学式分别是________、________,并说明原因.
查看答案和解析>>
科目:高中化学 来源: 题型:

在废水排出管的A、B处分别注入一定流量的废烧碱溶液和亚硫酸钠溶液。
试写出:
(1)A、B处应加入的物质的化学式:A_________、B_________。
(2)A、B两处反应的离子方程式:
A:________________________________________________________________;
B:________________________________________________________________。
(3)每处理1 m3的该废水,需加入0.05 mol·L-1的Na2SO3溶液的体积是多少?
(4)除去氯后的废水中H+的浓度约为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)请写出所发生反应的化学方程式,指出氯气在反应中的作用是否相同。_______________________________________________________________
(2)试写出A、B处应加入处理液的化学式分别是________________、________________,并说明原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂排出的废水中,经测定含0.012mol·L-1的游离溴和8×10-4mol·L-1的H+。若用加亚硫酸钠的方法除去溴,化学方程式为:Na2SO3+Br2+H2O === Na2SO4+2HBr。处理上述这种废水5L,问:
(1)需加入0.05mol·L-1的Na2SO3溶液多少升才能把溴除尽?
(2)除尽后废水的H+的物质的量浓度是多少?(假定溶液的体积为两者之和)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com