
| 元素代号[ | X | Y | Z | W |
| 原子半径/nm | 0.130 | 0.118 | 0.102 | 0.073 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | Z的氢化物的沸点比W的氢化物高 |
分析 Z和W的化合价都有-2价,应为周期表第ⅥA族元素,Z的最高价为+6价且原子半径较大,应则Z为S元素,W为O元素;X的化合价为+2价,为ⅡA族元素,Y的化合价为+3价,为ⅢA族元素,又由于原子半径X>Y>硫,则X为Mg、Y为Al,结合元素周期律与元素化合物性质解答.
解答 解:Z和W的化合价都有-2价,应为周期表第ⅥA族元素,Z的最高价为+6价且原子半径较大,应则Z为S元素,W为O元素;X的化合价为+2价,为ⅡA族元素,Y的化合价为+3价,为ⅢA族元素,又由于原子半径X>Y>硫,则X为Mg、Y为Al.
A.同周期自左而右金属性减弱,X、Y元素的金属性X(Mg)>Y(Al),故A错误;
B.一定条件下,Z单质与W的常见单质直接生成ZW2:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,故B正确;
C.Y的最高价氧化物对应的水化物为Al(OH)3,不能溶于稀氨水,故C错误;
D.Z、W的氢化物分别为硫化氢、水,水分子之间形成氢键,而硫化氢分子间无氢键,水的沸点高于硫化氢的,故D错误.
故选:B.
点评 本题考查元素位置结构和性质的关系及应用,题目难度中等,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,注意元素周期律的递变规律的应用.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| B | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 | 溶液中一定含有CO32- |
| C | 向某无色溶液中逐滴加入浓NaOH溶液,逐渐产生白色沉淀,然后沉淀逐渐消失 | 该溶液中一定含有Al3+ |
| D | 向某溶液中加入氯化银溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与FeCl3溶液的反应:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | Na2SiO3溶液中加入盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| C. | AgCl悬浊液中加入KI溶液得到黄色沉淀:Ag++I-═AgI↓ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
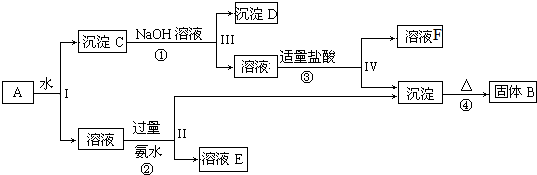
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 2NH3
2NH3查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com