
分析 (1)①醋酸钠溶液呈碱性是醋酸根离子水解的原因;
②用石墨做电极,电解硝酸银溶液,阳极是氢氧根离子失电子生成氧气,阴极是银离子得到电子生成银;
③根据硫代硫酸钠在硫酸溶液中自身发生氧化还原反应,由此可书写化学方程式;
(2)盐酸溶解锌反应完全后无气体放出,根据面积等于质量比密度,厚度等于面积比表面积判断;
(3)①根据反应方程式及高锰酸钾的物质的量计算出产品中FeSO4•7H2O的质量分数;
②根据题给信息判断,铁离子颜色呈黄色,干扰终点判断,而Fe3+(黄色)+2H3PO4=H3[Fe(PO4)2](无色)+3H+.
解答 解:(1)①醋酸钠溶液呈碱性是醋酸根离子水解,破坏水的电离平衡,溶液中氢氧根离子浓度增大,离子方程式为:CH3COO-+H2O?CH3COOH+OH-,
故答案为:CH3COO-+H2O?CH3COOH+OH-;
②用石墨做电极,电解硝酸银溶液,阳极是氢氧根离子失电子生成氧气,阴极是银离子得到电子生成银,反应的离子方程式为:4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+4H++O2↑,
故答案为:4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+4H++O2↑;
③硫代硫酸钠在硫酸溶液中自身发生氧化还原反应,对应的离子方程式为:S2O32-+2H+=S↓+SO2+H2O,
故答案为:S2O32-+2H+=S↓+SO2+H2O;
(2)当锌镀层完全反应后就是铁与盐酸反应,由于锌和铁的活泼性不同,反应速率就不同,测定试样与6mol/L盐酸溶液反应前后固体的质量变化,反应完全是不再生成氢气,面积等于质量比密度,厚度等于面积比表面积,设锌镀层为h,锌的密度为ρ,则h=$\frac{({m}_{1}-{m}_{2})}{2ρs}$,
故答案为:生成氢气的速率突然减慢,$\frac{({m}_{1}-{m}_{2})}{2ρs}$;
(3)①待测液消耗的高锰酸钾的物质的量为:0.02mol/L×VmL×10-3L/mL=2V×10-5mol,
根据反应:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,硫酸亚铁的物质的量为:2V×10-5mol×5=V×10-4mol,
所以样品中含有的FeSO4•7H2O的质量为:278g/mol×V×10-4mol=2.78V×10-2g,
FeSO4•7H2O的质量分数为:$\frac{2.78V×1{0}^{-2}g}{1g}$×100%=2.78V%,
故答案为:2.78V;
②铁离子颜色呈黄色,干扰终点判断,而Fe3+(黄色)+2H3PO4=H3[Fe(PO4)2](无色)+3H+,消除了铁离子干扰,
故答案为:消除Fe3+的颜色干扰.
点评 本题考查对实验原理与操作步骤的理解及评价、化学计算、物质组成的测定,滴定实验中绿矾的质量分数的计算,磷酸的作用分析等,难度较大,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力,理解实验原理是解答的关键,注意锌的厚度计算时锌的面积是2s而不是s,为易错点.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:多选题
| A. | 丙烯酸和油酸互为同系物 | |
| B. | 淀粉和纤维素互为同分异构体 | |
| C. | CuSO4浓溶液能使蛋白质溶液发生盐析 | |
| D. | 麦芽糖和脂肪在一定条件下都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②①③ | C. | ③①② | D. | ③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
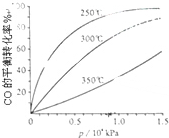 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 96% | B. | 48% | C. | 9.6% | D. | 56% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
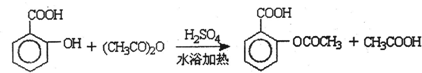
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数 | B. | 密度 | C. | 质子数 | D. | 质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出 | |
| C. | 制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 | |
| D. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com