
【题目】以饱和食盐水、NH3和CO2为原料,可以制取纯碱。下列说法正确的是( )
A.由反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0可知反应物所含键能总和大于生成物所含键能总和
2NH3(g) ΔH<0可知反应物所含键能总和大于生成物所含键能总和
B.常温常压下,电解饱和食盐水时,每生成2.24LCl2,电路中转移0.2mol电子
C.室温下,稀释纯碱溶液时,溶液的pH减小
D.反应Na2O(s)+CO2(g)=Na2CO3(s)常温下可自发进行,该反应为吸热反应
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许![]() 通过。电池放电的化学方程式为
通过。电池放电的化学方程式为![]() 。当闭合K时,X极附近溶液先变红色。下列说法正确的是( )
。当闭合K时,X极附近溶液先变红色。下列说法正确的是( )
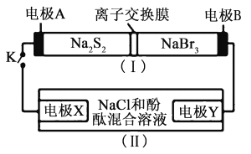
A.装置(Ⅰ)中A为正极
B.电极X的电极溶液变红的原因![]()
C.放电时,电极B的电极反应式为![]()
D.给原电池充电时![]() 从右向左通过离子交换膜
从右向左通过离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
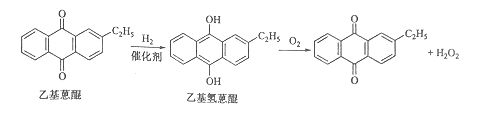
【题目】双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
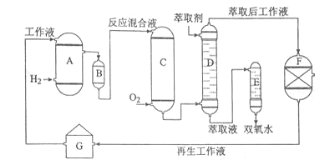
A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E..净化塔 F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是_______,循环使用的原料是______,配制工作液时采用有机溶剂而不采用水的原因是______。
(2)氢化釜A中反应的化学方程式为_______,进入氧化塔C的反应混合液中的主要溶质为_______。
(3)萃取塔D中的萃取剂是____,选择其作萃取剂的原因是______。
(4)工作液再生装置F中要除净残留的H2O2,原因是______。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
选项 | a(干燥气体) | b(液体) |
|
A | NO2 | 水 | |
B | CO2 | 饱和NaHCO3溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 1 mol·L-1盐酸 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
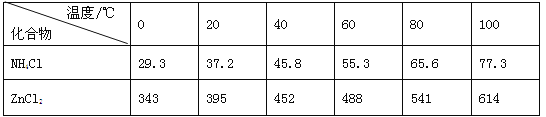
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为___。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过___分离回收;滤渣的主要成分是MnO2、___和_______,欲从中得到较纯的MnO2,最简便的方法是___,其原理是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。
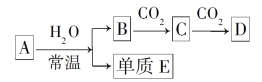
(1)若A为金属钠,A与水反应的离子方程式为_______________。
(2)若A为淡黄色的固体化合物,A________(填“是”或“不是”)碱性氧化物,A与CO2反应的化学方程式为_________________。
(3)A不论是Na还是淡黄色的固体化合物,依据转化关系判断物质C是________,物质D是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① X、Y、Z、W、R、Q为原子序数依次增大的短周期元素。X 是所有元素中原子半径最小的元素,Y是形成化合物种类最多的元素,W的最外层电子数是次外层电子数的3倍,Q与W同主族,Y、R原子的最外层电子数之和等于Z的最外层电子数。
②莱纳斯·卡尔·鲍林在1932年提出electronegativity作为元素原子在化合物某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的Electronegativity的值。
元素 | X | Y | Z | W | R | Q |
electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
元素 | Mg | Li | Al | Cl | P | Be |
electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
请回答下列问题(涉及X、Y、Z、W、R、Q时,用元素符号表示):
(1)根据上表给出的数据,可知元素的electronegativity越大,__(填“金属性”或“非金属性”)越强。
(2)元素Q在周期表中的位置为_________。
(3)W、R、Q单核简单离子半径由大到小排列顺序为______。
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式______________。
(5)一种由元素W、R组成的白色固体化合物,其电子式为_______________。
(6)试比较稳定性:X2W_____ X2Q;沸点:X2W_____ X2Q (填“<”或“>”)。
(7)元素 X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是_________。
A.2 B.4 C.5 D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯乙酸(CCl3COOH)是饮用水中常见污染物,难以直接氧化降解。通过Fe/Cu微电池法和芬顿法可将三氯乙酸除去。
(1)pH=4时,向含有三氯乙酸的水样中投入铁屑和铜屑,通过原电池反应生成的活性氢原子(H)将CCl3COOH脱氯后转化为CHCl2COOH。
①原电池反应时的负极反应式为___。
②写出活性氢原子(H)与CCl3COOH反应的离子方程式:___。
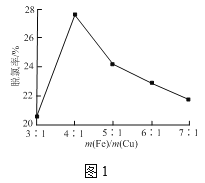
③铁屑和铜屑的总质量一定,改变铁屑和铜屑的质量比,水样中单位时间三氯乙酸的脱氯率如图1所示,当m(Fe)/m(Cu)大于4时,铁屑质量越大,脱氯率越低的原因是___。
(2)取上述反应后的溶液,向其中加入H2O2,发生图2所示转化,生成羟基自由基(·OH),·OH能将溶液中的CHCl2COOH等物质进一步脱氯除去。
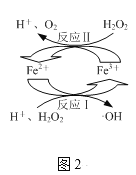
①图2所示转化中化合价未发生变化的元素是___。
②写出图2所示转化中反应Ⅱ的离子方程式:___。
③控制水样的pH不同,所得脱氯率如图3所示,当pH>4后,脱氯率逐渐下降的原因是___。

④加入H2O2后需控制溶液的温度,温度过高时脱氯率减小的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 都属于多环烃类,下列有关它们的说法错误的是
都属于多环烃类,下列有关它们的说法错误的是
A. 这三种有机物的二氯代物同分异构体数目相同
B. 盘烯能使酸性高锰酸钾溶液褪色
C. 棱晶烷和盘烯互为同分异构体
D. 等质量的这三种有机物完全燃烧,耗氧量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com