
【题目】决定气体体积的主要因素是:①气体分子直径 ②所含微粒数 ③气体相对分子质量 ④微粒间的距离
A.②③④B.②④C.①③④D.①②③④
科目:高中化学 来源: 题型:
【题目】三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

⑴氯化水解法生产三氯氧磷的化学方程式为______。
⑵通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取ag产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是______(选填字母),滴定终点的现象为______。
a.NH4Fe(SO4)2 b.FeCl2 c.甲基橙 d.淀粉
②实验过程中加入硝基苯的目的是_____________________,如无此操作所测Cl元素含量将会______(填“偏大”、“偏小”或“不变”)
⑶氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是_________________。
②下图是不同条件对磷的沉淀回收率的影响图像。
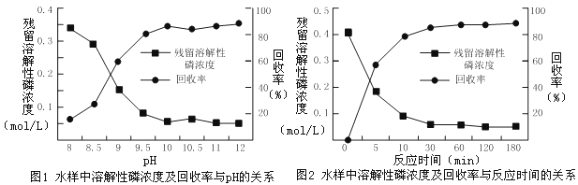
处理该厂废水最合适的工艺条件为______(选填字母)。
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7mol·L-1,溶液中c(Ca2+)=__________mol·L-1。
(已知Ksp[Ca3(PO4)2]=2×10-29)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)丙烷是一种优良的燃料,下图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图。试回答下列问题:
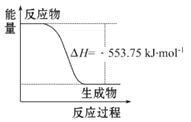
①写出表示丙烷燃烧热的热化学方程式:_________________________。
②二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ的热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ的热量,则混合气体中,丙烷和二甲醚的物质的量之比为_________________。
(2)盖斯定律认为:不管化学反应是一步完成或分步完成的,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g)H2O(l) ΔH1=-Q1kJ·mol-1
C2H5OH(g)C2H5OH(l) ΔH2=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g) ΔH3=-Q3kJ·mol-1
若使23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图所示为锌铜原电池。下列叙述中,正确的是

A. 盐桥的作用是传导离子
B. 外电路电子由铜片流向锌片
C. 锌片上的电极反应式为Zn2+ +2e- = Zn
D. 外电路中有0.2 mol 电子通过时,铜片表面增重约3.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生成锂离子电池。下列说法正确的是
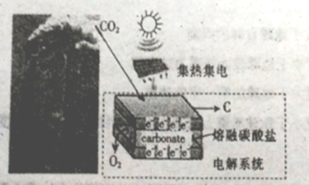
A. 图中能量转化方式只有一种
B. 阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑
C. 若反应中转移1mole-,则理论上消耗CO32-0.5mol
D. 当生成12g碳材料时,可收集到22.4LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+Cl2(g) ![]() 2HCl(g)反应的能量变化示意图如下:
2HCl(g)反应的能量变化示意图如下:

下列说法正确的是
A. 点燃条件和光照条件下,反应的ΔH不同
B. 反应的ΔH约为[2c- (a+b)]kJ·mol-1
C. “假想的中间物质”的总能量低于起始态H2和Cl2的总能量
D. 反应涉及的物质中,既有含极性键的物质,也有含非极性键的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔融) ![]() 4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH(熔融)
4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH(熔融) ![]() Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是

A. 电解熔融氢氧化钠制钠,阳极发生的电极反应为2OH--2e-===H2↑+O2↑
B. 盖·吕萨克法制钠原理是利用铁的还原性比钠强
C. 若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D. 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨为阳极,铁为阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:锌与浓硫酸共热除生成二氧化硫气体外,还可能产生氢气;在加热的条件下二氧化硫可被CuO氧化。为验证该反应的气体产物及性质,设计了如下图所示的实验装置(设锌与浓硫酸共热时产生的气体为X)。
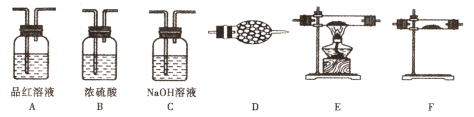
(1)上述装置的连接顺序为:气体X→A→____→A→ → → →D;
(2)反应开始后,观察到第一个装置A中的品红溶液褪色,实验结束后取适量该溶液于试管中并加热,现象为_______________________________________;
(3)装置 C中的NaOH溶液能用下列____代替;
a.酸性KMnO4溶液 b.CaCl2溶液 c.饱和NaHSO3溶液
装置D的作用是____________________________
(4)气体X中可能含有H2的原因是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com