
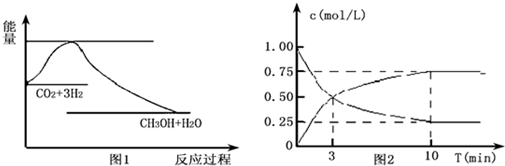
分析 (1)正反应气体的物质的量减少,混乱度减小;由于反应物能量高于生成物的能量,反应是放热反应;
(2)二氧化碳是反应物,随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大,10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L,则:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
起始量(mol/L):1 4 0 0
变化量(mol/L):0.75 2.25 0.75 0.75
平衡量(mol/L):0.25 1.75 0.75 0.75
①根据c=$\frac{△c}{△t}$计算v(CO2),氢气转化率=$\frac{氢气浓度变化量}{氢气起始浓度}$×100%;
②平衡常数是:一定温度下,可逆反应得到平衡时,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积之比;
③A.反应是放热反应,升温平衡逆向进行;
B.将CH3OH(g)及时液化抽出,减小生成物的量平衡正向进行;
C.选择高效催化剂只能改变速率,不改变化学平衡;
D.再充入l molCO2和3molH2,增大压强平衡正向进行;
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,则1mol甲醇完全燃烧恢复到原状态时,放出热量=363.3kJ×$\frac{1mol×32g/mol}{16g}$=726.6kJ,注明物质的聚集状态与反应热书写热化学方程式;
(4)本质是甲醇燃烧生成二氧化碳与水,生成的二氧化碳与氢氧化钠反应反应生成碳酸钠,而负极发生氧化反应,则负极应加入的物质有甲醇、氢氧化钠、水,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水.
解答 解:(1)正反应气体的物质的量减少,混乱度减小,故△S<0;由于反应物能量高于生成物的能量,反应是放热反应,则△H<0,
故选:A;
(2)二氧化碳是反应物,随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大,10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L,则:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
起始量(mol/L):1 4 0 0
变化量(mol/L):0.75 2.25 0.75 0.75
平衡量(mol/L):0.25 1.75 0.75 0.75
①则v(CO2)=$\frac{0.75mol}{10min}$=0.075mol/(L•min),氢气的转化率=$\frac{2.25mol/L}{4mol/L}$×100%=56.25%,
故答案为:0.075mol/(L•min);56.25%;
②平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$,故答案为:$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;
③A.反应是放热反应,升温平衡逆向进行,故A错误;
B.将CH3OH(g)及时液化抽出,减小生成物的量平衡正向进行,故B正确;
C.选择高效催化剂只能改变速率,不改变化学平衡,故C错误;
D.再充入l molCO2和3molH2,增大压强平衡正向进行,故D正确,
故选:BD;
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,则1mol甲醇完全燃烧恢复到原状态时,放出热量=363.3kJ×$\frac{1mol×32g/mol}{16g}$=726.6kJ,故甲醇燃烧的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1;
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1;
(4)本质是甲醇燃烧生成二氧化碳与水,生成的二氧化碳与氢氧化钠反应反应生成碳酸钠,而负极发生氧化反应,则负极应加入的物质有甲醇、氢氧化钠、水,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH3OH+8OH?-6e-=CO32-+6H2O,
故答案为:甲醇、氢氧化钠、水;CH3OH+8OH?-6e-=CO32-+6H2O.
点评 本题考查化学平衡计算与影响因素、热化学方程式书写、原电池等,注意对基础知识的理解掌握,难度中等.


科目:高中化学 来源: 题型:选择题
| 组号 | 反应温度 (℃) | 参加反应的物质 | H2O体积(mL) | |||
| Na2S2O3 | H2SO4 | |||||
| 体积(mL) | 浓度(mol.L-1) | 体积(mL) | 浓度(mol.L-1) | |||
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是中学化学常见的装置,可用该装置验证元素非金属性的强弱.
如图是中学化学常见的装置,可用该装置验证元素非金属性的强弱. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 ;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.
;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
| 物质鉴定试验 | 推导结论 |
| ①用pH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性 | A、B中含有的阴离子为CO32-、OH-,C、D、E中含有的阳离子为H+、Al3+、Ag+ |
| ②A溶液与E溶液反应,既有气体产生又有沉淀产生,A与C反应只有气体产生 | A为Na2CO3,C含H+ |
| ③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀 | D为AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1.8g的NH4+离子中含有的电子数为NA | |
| C. | 11.2 L氧气所含的原子数为NA | |
| D. | 常温常压下,48gO3和O2的混合气体中含有的氧原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com