
【题目】NH4HSO4 在分析试剂、医药、电子工业中用途广泛。室温时,向100mL0.lmol·L-1 NH4HSO4 溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH 与NaOH 溶液体积的关系曲线如图所示。下列说法正确的是
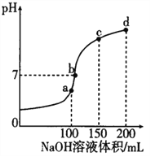
A. a点溶液中:c(NH4+)+c(H+)=c(Na+) +c(OH-)
B. c点溶液中:c(SO42-)>c(NH3·H2O)>c(NH4+)
C. d点溶液中:c(SO42-) >c(NH4+)>c(OH-)
D. a、b、c、d 四个点中,b点水的电离程度最大
【答案】A
【解析】
通过图像中反应量的关系可知,当氢氧化钠体积为100mL时,向100mL0.lmol·L-1NH4HSO4 溶液中滴加0.1mol·L-1NaOH溶液100 mL,恰好完全反应:NH4HSO4+NaOH=NaNH4SO4+H2O,a点溶液为硫酸钠和硫酸铵;据此进行分析,当氢氧化钠体积为150mL时,c点为硫酸钠、硫酸铵和一水合氨;当氢氧化钠体积在100-150mL之间时,溶液可以为中性,b点为硫酸钠、硫酸铵和一水合氨;当氢氧化钠体积为200mL时,d点为硫酸钠和一水合氨;据以上分析解答。
通过图像中反应量的关系可知,当氢氧化钠体积为100mL时,向100mL0.lmol·L-1NH4HSO4 溶液中滴加0.1mol·L-1NaOH溶液100 mL,恰好完全反应:NH4HSO4+NaOH=NaNH4SO4+H2O,a点溶液为硫酸钠和硫酸铵;据此进行分析,当氢氧化钠体积为150mL时,c点为硫酸钠、硫酸铵和一水合氨;当氢氧化钠体积在100-150mL之间时,溶液可以为中性,b点为硫酸钠、硫酸铵和一水合氨;当氢氧化钠体积为200mL时,d点为硫酸钠和一水合氨;
A. 结合以上分析可知,a点溶液为硫酸钠和硫酸铵,铵根离子水解,所以a点溶液显酸性,溶液中存在电荷守恒:c(NH4+)+c(H+)+c(Na+)=2c(SO42-)+c(OH-);物料守恒:c(Na+)=c(SO42-),所以c(NH4+)+c(H+)=c(Na+) +c(OH-),A正确;
B. 结合以上分析可知,c点溶液含有硫酸钠、硫酸铵和一水合氨,因为一水合氨的电离程度大于铵根离子的水解程度,c(SO42-)>c(NH4+)>c(NH3·H2O),B错误;
C. 结合以上分析可知,d点溶液中含有硫酸钠、一水合氨,溶液显碱性,c(SO42-)>c(OH-)>c(NH4+),C错误;
D.因为加酸和碱抑制水的电离,盐类的水解促进水的电离,所以图中的a、b、c、d 四个点中,a点水的电离程度最大,D错误;
综上所述,本题选A。


科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。

实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往锅炉注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸去除,下列叙述正确的是
A. 温度升高Na2CO3溶液的Kw和c(H+)均会增大
B. CaSO4能转化为CaCO3,说明Ksp(CaCO3)>Ksp(CaSO4)
C. CaCO3溶解于盐酸而CaSO4不溶,是因为硫酸酸性强于盐酸
D. 沉淀转化的离子方程式为CO32(aq)+CaSO4(s)![]() CaCO3(s)+SO42(aq)
CaCO3(s)+SO42(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。回答下列问题:
(1)基态Ga原子价层电子的轨道表达式为_________________________,第一电离能介于N和B之间的第二周期元素有_______种。
(2)HCN分子中σ键与π键的数目之比为_______,其中σ键的对称方式为___________。与CN—互为等电子体的分子为___________。
(3)NaN3是汽车安全气囊中的主要化学成分,其中阴离子中心原子的杂化轨道类型为_________。NF3的空间构型为____________。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因_________________________________________________________。
GaN | GaP | GaAs | |
熔点 | 1700℃ | 1480℃ | 1238℃ |
(5)GaN晶胞结构如下图所示。已知六棱柱底边边长为a cm,阿伏加德罗常数的值为NA。


① 晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为_____________;
② GaN的密度为______________________g·cm3(用a、NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. H+、Ca2+、Cl、CO32 B. Cu2+、Ba2+、Cl、SO42
C. NH4+、Na+、OH、SO42 D. K+、Na+、OH、NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物能形成酸雨和光化学烟雾,严重污染环境。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________。
(2)在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,在一定条件下发生反应,反应过程中NO的物质的量随时间变化如图所示。

①写出该反应的化学方程式______________________________________。
②10 min内该反应的速率v(CO)=__________________;T℃时,该化学反应的平衡常数K=_______。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________。(填序号)

④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,下列选项能判断反应已达到化学平衡状态的是____________。
A.容器中压强不再变化 B.混合气体的平均相对分子质量不再变化
C.2v正(NO)=v逆(N2) D.气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)和氧气的反应情况受温度影响。某同学设计方案探究温度对产物影响的结果如图所示。下列说法不正确的是
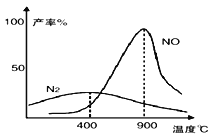
A. 温度较低时, 肼和氧气主要发生的反应N2H4+O2 = N2+2H2O
B. 900℃时,能发生 N2+O2 = 2NO
C. 900℃时, N2的产率与 NO 的产率之和可能小于 1
D. 该探究方案是将一定量的肼和氧气、在密闭容器中进行不断升温实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g) ![]() C(g)+D(g),5min后达到平衡,各质的平衡浓度的关系为:[A]a[B]=[C][D]。此时若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
C(g)+D(g),5min后达到平衡,各质的平衡浓度的关系为:[A]a[B]=[C][D]。此时若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
A. 60% B. 40% C. 24% D. 4%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒温、恒容(2L)的密闭容器中充入2molSO2和一定量的O2发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H= —197.74KJ.mol-1,4min后达到平衡,这时c(SO2)=0.2mol.L-1,且SO2与O2的转化率相等。下列说法中不正确的是
2SO3(g) △H= —197.74KJ.mol-1,4min后达到平衡,这时c(SO2)=0.2mol.L-1,且SO2与O2的转化率相等。下列说法中不正确的是
A. 达到平衡时再充入2mol SO2反应的△H保持不变。
B. 用O2表示4min内的反应速率为0.1mol·(L·min)-1
C. 再向容器中充入1mol SO3,达到新平衡,n(SO2)∶n(O2)=2∶1
D. 4min后,若升高温度,平衡向逆反应方向移动,平衡常数K增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com