
【题目】如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热
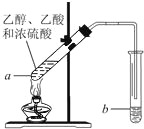
(1)写出左试管中主要反应的方程式________________;
(2)饱和Na2CO3的作用:___________;_______________________;_________;
(3)分离右试管中所得乙酸乙酯和Na2CO3溶液的操作所需主要仪器是____________.
(4)实验生成的乙酸乙酯,其密度比水________.
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】益康唑是一种抗真菌药物,可通过以下方法合成:
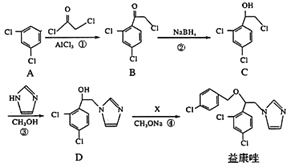
(1)化合物B中含有的官能团名称为________、________;反应②的类型是______反应
(2)反应④中加入的试剂X分子式为C7H6Cl2,则X的结构简式为____________
(3)同时满足下列条件的C的同分异构体一共有_______种;请写出其中任意一种的的结构简式:______________________。
I.能与FeCl3溶液发生显色反应;II.分子中只有2种不同化学环境的氢。
(4)在一定条件下,化合物C与足量氢氧化钠溶液反应的化学方程式为:__________________。
(5)根据本题的相关信并结合已有知识,写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图(乙醇和无机试剂任用)________。合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(乙醇和无机试剂任用)________。合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验方法和结论正确的是 ( )
A. 加入硝酸银溶液有白色沉淀生成,证明原溶液中一定有Cl-
B. 在加入稀硝酸后的溶液中,再滴加氯化钡溶液有白色沉淀生成,证明原溶液中一定有SO![]()
C. 加入盐酸后加热,放出能使澄清石灰水变浑浊的无色无味气体,证明原溶液中一定含有CO![]()
D. 加入紫色石蕊试液,溶液显红色,证明溶液一定呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备肥皂的过程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答:
(1)加入乙醇的目的是__________________________________________。
(2)证明油脂完全反应的方法是_____________________________________________________。
(3)以硬脂酸甘油酯为例,写出皂化反应的方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2CO3·10H2O晶体配制0.20 mol/L Na2CO3溶液480 mL。
(1)实验时要用到的玻璃仪器有:除托盘天平、量筒、烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是___________________,在使用该仪器前必须进行的操作是_______________________。
(2)应用托盘天平称取Na2CO3·10H2O晶体的质量为___________g。
(3)配制溶液时有以下几个操作:

简述定容的过程:_______________________________。
(4)配制过程中,下列操作对所配溶液的浓度有什么影响,完成填空。
a.Na2CO3·10H2O晶体不纯,混有NaCl
b.用“左码右物”的称量方法称量晶体
c.容量瓶中洗净后未干燥,残留少量水
d.未冷却至室温就转移定容
e.加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出
f.定容时,俯视刻度线
会引起所配溶液的浓度偏大的有________,无影响的有________。(填序号)
(5)如果直接使用浓度为2.00mol/L的Na2CO3溶液来配制100mL 1.00mol/L的Na2CO3溶液,需要量取2.00mol/L的Na2CO3溶液的体积为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L ②若1 mol气体的体积为22.4 L,则它一定处于标准状况下 ③标准状况下,1 L HCl和1 L H2O的物质的量相同 ④标准状况下,1 g H2和14 g N2的体积相同 ⑤28 g CO的体积为22.4 L ⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同 ⑦在同温同体积时,气体物质的物质的量越大,则压强越大 ⑧同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ⑤⑥⑦⑧ D. ④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B两种烃,其相关信息如下:
A ①完全燃烧的产物中n(CO2):n(H2O)=2:1
②28<M (A)<60
③不能使溴的四氯化碳溶液褪色④一氯代物只有一种结构
B ①饱和链烃,通常情况下呈气态②有同分异构体
③二溴代物有三种
回答下列问题:
(1)烃A的实验式是 ;
(2)烃A的结构简式是 ;
(3)烃B的三种二溴代物的结构简式为 、 、 ;
(4)烃C为烃B的同系物,常温下为气态且只有一种一溴代物,则烃C的一溴代物的结构简式为 (填一种即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. E的产量是衡量一个国家石油化工水平发展的标志,F为高分子化合物,能进行如图所示的反应。

(1)请写出E的电子式_______________。
(2)下列反应的化学方程式:(要求有机物必须写结构简式)
反应②:________________________ 反应类型________。
反应③:________________________ 反应类型________。
反应④:____________________反应类型________。
反应⑤:____________________反应类型________。
(3)比较反应①剧烈程度_____________(填>、= 或<)钠和水反应的剧烈程度。
Ⅱ.2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:

它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应 B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素” 的分子式是C12H10O5 D.“亮菌甲素”分子中含氧官能团只有2种
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其所有属于醇类的同分异构体的结构简式_______________________________。
(3)依据核磁共振氢谱分析,二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中含碳、氧元素的质量分数相同,且氢元素的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇的结构简式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期。B元素原子含有3个能级,且毎个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子。请回答下列问题:
(1)写出C基态原子的价层电子排布____________,F基态原子的外围电子排布式_____________。
(2)下列说法不正确的是____________ (填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.笫一电离能由小到大的顺序:B <C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O> H2S,水分子更稳定的原因是水分子间存在氢键
(3)F元素位于周期表中_________区,其离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通人过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为__________(用元素符号表示)。
(4)某化合物与F(I)(I表示化合价为+ 1)结合形成下图1所示的离子,该离子中碳原子的杂化方式为________________________________。
(5)B单质的一种同素异形体的晶胞如下图2所示,则一个晶胞中所含B原子的个数为____________。
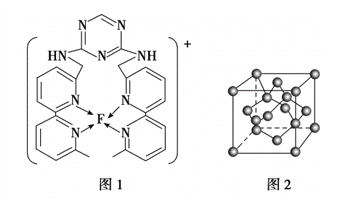
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm, F离子的半径bpm,则该晶胞的空间利用率为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com