
| A. | 在溶液中加硫酸钠溶液,有白色沉淀生成,则证明原溶液中一定有Ba2+ | |
| B. | 气体通过CuSO4粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 某溶液中加入稀硫酸,放出无色无味气体,将该气体通入澄清石灰水,溶液变浑浊,证明原溶液中一定含有CO32- |
分析 A.加硫酸钠溶液,有白色沉淀生成白色沉淀为硫酸钡或硫酸钙等;
B.无水硫酸铜遇水变蓝;
C.焰色反应为元素的性质,观察K的焰色反应需要透过蓝色的钴玻璃观察;
D.加入稀硫酸,放出无色无味气体,将该气体通入澄清石灰水,溶液变浑浊,气体为二氧化碳.
解答 解:A.加硫酸钠溶液,有白色沉淀生成白色沉淀为硫酸钡或硫酸钙等,则原溶液中可能有Ba2+,故A错误;
B.无水硫酸铜遇水变蓝,则气体通过CuSO4粉末变蓝,证明原气体中含有水蒸气,故B正确;
C.焰色反应为元素的性质,观察K的焰色反应需要透过蓝色的钴玻璃观察,则火焰呈黄色,证明原粉末中有Na元素,不能确定是否含K元素,故C错误;
D.加入稀硫酸,放出无色无味气体,将该气体通入澄清石灰水,溶液变浑浊,气体为二氧化碳,则原溶液中可能含有CO32-或HCO3-,或二者均存在,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握离子的检验、物质的检验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2 (g)+O2 (g)?2NO(g) | 工业固氮 N2 (g)+3H2 (g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
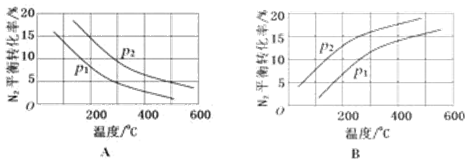
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| B. | 等物质的量的甲烷和乙酸完全燃烧消耗氧气的量相等 | |
| C. | 把溴水分别加到足量NaOH溶液和己烯中,充分反应后溶液都呈无色,所以不能用溴水鉴别这两种物质 | |
| D. | 检验某溶液中是否含有乙醛:在盛有2 mL 10%CuSO4溶液的试管中滴加0.5mL10%NaOH溶液,混合均匀,滴入待检液,加热,看是否产生砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Cl2发生还原反应 | |
| B. | 该反应中S2O32-为还原剂,Cl-为还原产物 | |
| C. | 脱氯反应后,溶液的酸性增强 | |
| D. | SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 氢氧化铜溶液与硫酸反应:OH-+H+═H2O | |
| C. | 二氧化硅与氢氧化钠溶液反应:SiO2+2OH-═H2SiO3 | |
| D. | 碳酸钙与醋酸反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的电子式: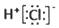 | |
| B. | 质子数为6,中子数为8的核素:${\;}_{6}^{14}$C | |
| C. | Na+的结构示意图: | |
| D. | CH4分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
| ② | 滴加淀粉KI溶液,振荡 | 溶液无变化 |
| ③ | 然后再滴加稀H2SO4溶液,振荡 | 溶液变蓝色 |
| 实验操作 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
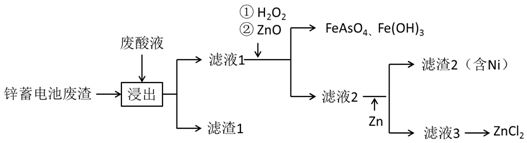
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com