
| A、合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| B、氯碱工业中,使用离子交换膜可防止Cl2和NaOH溶液反应 |
| C、硫酸工业中,接触室内安装热交换器,是为了利用沸腾炉中排出的SO2的热量 |
| D、硫酸工业中,SO2的催化氧化不采用高压,是因为压强对SO2转化率无影响 |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
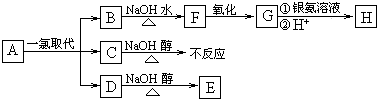
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、等于0.3mol |
| B、等于0.15mol |
| C、小于0.15mol |
| D、大于0.15mol,小于0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol |
| B、1.2 mol |
| C、0.1mol |
| D、1.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、应准确称取氢氧化钠固体19.2g |
| B、为了减少损失,将氢氧化钠固体直接倒入容量瓶中,加水溶解 |
| C、定容时仰视读数,所配制的溶液浓度会偏低 |
| D、摇匀后溶液液面低于刻度线,应补充适量蒸馏水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
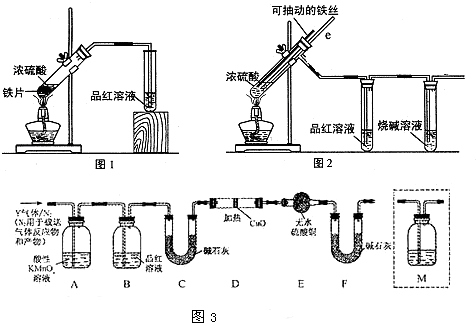
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定有Al3+、Mg2+、Cl-,可能有NH4+、K+ |
| B、肯定有Al3+、K+、Cl-,肯定没有MnO4- |
| C、肯定有Al3+、Cl-,一定没有HCO3-和SO42- |
| D、该溶液可能显弱酸性,也可能显中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com