
| A、1.8 g D2O含有NA个中子 |
| B、用5 mL 3 mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015 NA |
| C、在Na2O2与CO2的反应中,每转移NA个电子时,消耗22.4 L的CO2 |
| D、25℃时,7 g C2H4和C3H6的混合气体中,含有NA个C-H键 |
| 1.8g |
| 20g/mol |
| 7g |
| 14ng/mol |
| 1 |
| 2n |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、混合前一元酸HA的c(H+)=0.1 mol?L-1 |
| B、该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| C、HA在水溶液中的电离方程式:HA=H++A- |
| D、该混合溶液中:c(A-)+c(HA)=0.1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应A(g)?2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ?mol-1,则△H=(Ea-Eb)kJ?mol-1 | ||
| B、标准状态下,将0.1 mol?L-1 的氨水溶液中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) | ||
| C、足量的锌铜合金与100mL pH=1 稀硫酸反应,反应3s 时测得pH=2,假设反应前后溶液的体积保持不变,则3s 内产生氢气的平均速率是33.6 mL?s-1 | ||
D、将浓度为0.1mol?L-1HF 溶液加水不断稀释过程中,电离度(α)和Ka(HF)保持不变,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
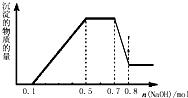 溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A、溶液中一定不含CO32-,可能含有SO42-和NO3- |
| B、在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=AlO2-+2H2O |
| C、溶液中的阳离子只有H+、Mg2+、Al3+ |
| D、n(H+):n(NH4+):n(Mg2+)=2:4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
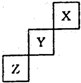
| A、相同条件下,三种元素的单质跟氢气反应时,X单质最剧烈 |
| B、Y的气态氢化物稳定性比Z的气态氢化物的稳定性强 |
| C、ZO2能与Z的最高价氧化物对应的水化物反应生成Z单质 |
| D、由氢、氧和Z元素形成的常见化合物中既含有离子键又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
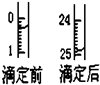 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | 0.50 | 25.95 | 25.45 |
| 2 | 25.00 | |||
| 3 | 25.00 | 6.00 | 31.55 | 25.55 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com