(2009?广东模拟)在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应.请设计实验,证明还原铁粉与水蒸气能够发生反应.
(1)铁粉与水蒸气反应的化学方程式是:
(2)证明还原铁粉与水蒸气发生了反应的方法是
检验是否有H2产生
检验是否有H2产生
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实验装置示意图(铁架台可省略,导气管的形状可根据需要选择)
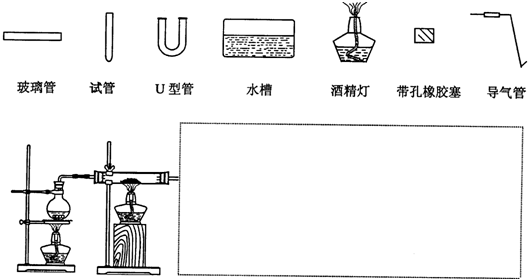
(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤.若混合物中既有Fe
2+又有Fe
3+,则证明该结论的实验方法是:
各取少量溶液于两试管中,向其中一试管中滴入几滴KSCN溶液,向另一试管中加入高锰酸钾酸性溶液,观察溶液颜色变化,若前者溶液颜色变红,后是溶液紫红色褪去,则说明溶液中既有Fe2+又有Fe3+
各取少量溶液于两试管中,向其中一试管中滴入几滴KSCN溶液,向另一试管中加入高锰酸钾酸性溶液,观察溶液颜色变化,若前者溶液颜色变红,后是溶液紫红色褪去,则说明溶液中既有Fe2+又有Fe3+
(5)经检验上述滤液中不含Fe
3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素.原因是(结合离子方程式说明)
如果反应后混合物中的铁粉过量,铁粉将溶液中的Fe3+全部还原为Fe2+,即便加KSCN溶液也不变红色.反应的离子方程式为Fe+2Fe3+=3Fe2+
如果反应后混合物中的铁粉过量,铁粉将溶液中的Fe3+全部还原为Fe2+,即便加KSCN溶液也不变红色.反应的离子方程式为Fe+2Fe3+=3Fe2+
(6)某同学利用上述滤液制取白色的Fe(OH)
2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色.
①沉淀由白色→红褐色的化学方程式是:
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
.
②为了得到白色的Fe(OH)
2沉淀,并尽可能长时间保持其白色,可采取的措施有多种,请写出其中的一种.
第一种:用一只容器较大针孔较细的注射器吸取滤液后再吸入NaOH溶液,然后倒置2~3次;
第二种:向滤液中加入植物油,使滤液与空气隔绝,然后再将滴管伸入水溶液中滴加氢氧化钠溶液;
第三种:向热的硫酸亚铁溶液中滴加热的氢氧化钠溶液,减少溶液中氧气的含量.
第一种:用一只容器较大针孔较细的注射器吸取滤液后再吸入NaOH溶液,然后倒置2~3次;
第二种:向滤液中加入植物油,使滤液与空气隔绝,然后再将滴管伸入水溶液中滴加氢氧化钠溶液;
第三种:向热的硫酸亚铁溶液中滴加热的氢氧化钠溶液,减少溶液中氧气的含量.
.



 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验. 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验. 某同学用如图所示装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.
某同学用如图所示装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应. 某同学用如图所示装置制取乙酸乙酯.在试管甲中加入适量的乙醇、浓硫酸和冰醋酸,并加热3min~5min.请回答:
某同学用如图所示装置制取乙酸乙酯.在试管甲中加入适量的乙醇、浓硫酸和冰醋酸,并加热3min~5min.请回答: