【答案】
分析:(1)①平衡常数指平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
②a.随反应进行,气体的物质的量减小,容器内压强减小;
b.达平衡状态时正逆反应速率相等;
c.平衡时各组分的浓度、含量不变;
d.一定条件下,单位时间内消耗1mol CO,同时生成1mol CH
3OH,都表示正反应速率,自始至终都按此比例进行;
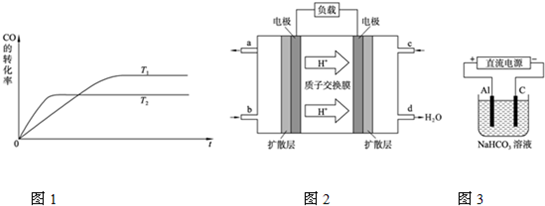
(2)根据先拐先平数值大原则,由图1可知,温度T
1<T
2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,据此判断反应热,K
1与K
2关系;提高甲醇产率,应采取措施,使平衡向正反应移动,结合平衡移动原理分析;
(3)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式;
(4)由装置图可知,b极通入气体后产生气体,c极通入气体后产生水,故b极通入为甲醇,c极通入的是氧气,原电池负极发生氧化反应,正极反应还原反应;
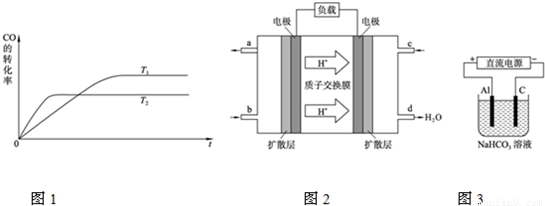
(5)电解池阳极发生氧化反应,金属Al放电生成Al
3+,Al
3+与HCO
3-发生双水解,生成Al(OH)
3.
解答:解:(1)①可逆反应:CO(g)+2H
2(g)?CH
3OH(g)的平衡常数k=

,故答案为:
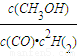
;
②a.随反应进行,气体的物质的量减小,容器内压强减小,容器内的压强不发生变化,说明到达平衡状态,故a正确;
b.CH
3OH分解的速率和CH
3OH生成的速率相等,说明正逆反应速率相等,说明到达平衡状态,故b正确;
c.平衡时各组分的浓度、含量不变,说明到达平衡状态,故c正确;
d.一定条件下,单位时间内消耗1mol CO,同时生成1molCH
3OH,都表示正反应速率,自始至终都按此比例进行,不能说明到达平衡状态,故d错误.
故答案为:d;
(2)由图1可知,温度T
1<T
2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应;升高温度,平衡向逆反应移动,所以K
1>K
2,
a.升高温度,平衡向逆反应移动,甲醇产率降低,故a错误;
b.将CH
3OH(g)从体系中分离,平衡向正反应移动,甲醇产率增大,故b正确;
c.使用合适的催化剂,缩短到达平衡时间,不影响平衡移动,甲醇产率不变,故c错误;
d.容器容积不变,充入He(g),使压强增大,但反应混合物的浓度不变,不影响平衡移动,甲醇产率不变,故d错误;
故b可以使甲醇产率增大,故答案为:<;>;b;
(3)已知:①2CH
3OH(1)+3O
2(g)=2CO
2(g)+4H
2O(g)△H=-a kJ?mol
-1②2CO(g)+O
2(g)=2CO
2(g)△H=-b kJ?mol
-1③H
2O(g)=H
2O(1)△H=-c kJ?mol
-1由盖斯定律可知,①-②+③×4得2CH
3OH(1)+2O
2(g)=2CO(g)+4H
2O(l)△H=-(a+4c-b) kJ?mol
-1故答案为:2CH
3OH(1)+2O
2(g)=2CO(g)+4H
2O(l)△H=-(a+4c-b) kJ?mol
-1;
(4)由装置图可知,b极通入气体后产生气体,c极通入气体后产生水,故b极通入为甲醇,c极通入的是氧气,原电池负极发生氧化反应,正极反应还原反应,氧气在正极放电,与氢离子结合生成水,正极电极反应式为O
2+4H
++4e
-=2H
2O,故答案为:甲醇;O
2+4H
++4e
-=2H
2O;
(5)电解池阳极发生氧化反应,金属Al放电Al-3e
-=Al
3+,生成Al
3+,Al
3+与HCO
3-发生双水解Al
3++3HCO
3-=Al(OH)
3↓+CO
2↑,生成Al(OH)
3溶液变浑浊,
故答案为:Al-3e
-=Al
3+,Al
3++3HCO
3-=Al(OH)
3↓+CO
2↑.
点评:本题考查平衡常数、平衡状态判断、平衡移动及图象、热化学方程式书写、原电池、电解池等,难度中等,需要学生具备扎实的基础与灵活运用能力.

 ,故答案为:
,故答案为: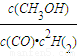 ;
;

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案