
下列说法中正确的是
A. 8NH3(g)+6NO2(g)=7N2(g)+12H2O(g);ΔH<0,则该反应一定能自发进行
B. 提取海带中碘元素时,为将I-完全氧化为I2,用HNO3作氧化剂比用H2O2效果好
C. 原电池放电过程中,负极质量一定减轻,正极的质量一定增加
D. 由于Ksp(MgCO3)<Ksp[Mg(OH)2],因此水垢中MgCO3会逐渐转化为Mg(OH)2
科目:高中化学 来源:2013-2014学年河北省唐山市高三4月第二次模拟理综化学试卷(解析版) 题型:填空题
W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质是大气污染物监测物之一;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为 。
(2)MX3-的空间构型 (用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是 。
(4)根据等电子原理,WX分子的结构式为 。
(5)1 mol WX2中含有的σ键数目为 。
(6)H2X分子中X原子轨道的杂化类型为 。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:填空题
硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤。请回答下列问题:
(1)该反应在恒温恒容密闭容器中进行,判断其达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)某温度下,2SO2(g)+O2(g)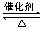 2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。试分析工业生产中采用常压的原因是 。

(4)将一定量的SO2和0.7 molO2放入一定体积的密闭容器中,在550℃和催化剂作用下发生反应。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。则该反应达到平衡时SO2的转化率是多少?(要写出计算过程,计算结果保留一位小数。)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:选择题
化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是
A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
B.使用生物酶降解生活废水中的有机物,可防止水体的富营养化
C.上海世博会很多展馆采用光电转化装置,体现当今“低碳”经济的理念
D.利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是

A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用均正确的是
A.Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒
B.氨气是一种碱性气体,可用P2O5或无水CaCl2干燥
C.SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力
D.油脂在碱性条件下易水解,可用于制作肥皂
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:填空题
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。Ⅰ、实验室制取的方法之一是:Ca(OH)2 +2HCHO + H2O2 = Ca(HCOO)2 + 2H2O + H2↑。
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1∶2∶1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品。
(1)过氧化氢比理论用量稍多,其目的是 。
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是 。
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是 。
(4)实验时需强力搅拌45min,其目的是 ;结束后需调节溶液的pH 7~8,其目的是 。最后经结晶分离、干燥得产品。
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算),现提供的试剂有:a.甲酸钠,b.5mol·L-1硝酸,c. 5mol·L-1盐酸,d. 5mol·L-1硫酸,e. 3%H2O2溶液,f.澄清石灰水。
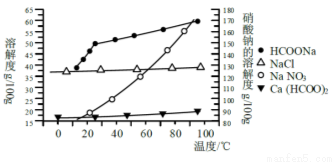
请补充完整由碳酸钙制备甲酸钙的实验步骤
金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
Fe3+ | 1. 1 | 3. 2 |
Al3+ | 3. 0 | 5. 0 |
Fe2+ | 5. 8 | 8. 8 |
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶待用,并称取研细的碳酸钙样品10g待用。
步骤2. 。
步骤3. 。
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、 、洗涤、60℃时干燥得甲酸钙晶体。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.乙醇的结构简式 C2H6O
B.氨基的电子式 
C.镁离子的结构示意图 
D.中子数为79、质子数为55 的铯(Cs)原子 Cs
Cs
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省潮州市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成a-萜品醇G的路线之一如下:
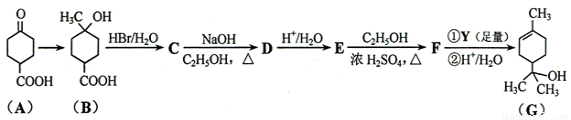
已知:RCOOC2H5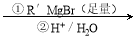

请回答下列问题:
(1)A所含官能团的名称是________________, B的分子式为 。
(2)B → C、E → F的反应类型分别为_____________、_____________。
(3)C → D的化学方程式为________________________________________________。
(4)写出同时满足下列条件的B的链状同分异构体的结构简式:_____________。
①核磁共振氢谱有2个吸收峰 ②能发生银镜反应
(5)试剂Y的结构简式为______________________。
(6)G与H2O催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H,写出H的结构简式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com