
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| 实验 | 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 1/3 | 3 | |
| 3 | 900 | a | b | c | t | |
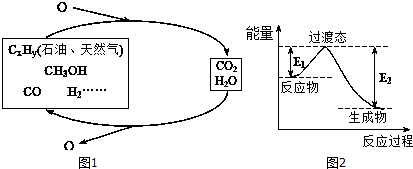
分析 (1)反应热等于反应物总键能减去生成物的总键能,而二氧化碳与氢气反应生成甲醇的反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),可知该反应的反应热△H=(2×745+3×436-2×462.8-3×413.4-351-462.8)kJ•mol-1=-181.6kJ•mol-1,由图可知:△H=E1-E2,由此分析解答;
(2)①650℃根据方程式可知
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 4 2 0 0
转化量(mol)1.6 1.6 1.6 1.6
平衡量(mol)2.4 0.4 1.6 1.6
因为两的计量数相等,所以反应前后体积不变,可以用物质的量代替浓度计算平衡常数,则该反应的平衡常数为K=$\frac{1.6×1.6}{2.4×0.4}$=$\frac{8}{3}$;
900℃根据方程式可知
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol)2 1 0 0
转化量(mol)$\frac{2}{3}$ $\frac{2}{3}$ $\frac{2}{3}$ $\frac{2}{3}$
平衡量(mol)$\frac{4}{3}$ $\frac{1}{3}$ $\frac{2}{3}$ $\frac{2}{3}$
此时平衡常数K=$\frac{\frac{2}{3}×\frac{2}{3}}{\frac{4}{3}×\frac{1}{3}}$=1,而$\frac{8}{3}$>1,这说明升高温度平衡常数减小,因此升高温度平衡向逆反应方向进行,由此分析解答;
②根据以上分析可知实验2条件下的平衡常数K=1;
③实验3中,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol)a b 0 0
转化量(mol)c c c c
平衡量(mol)a-c b-c c c
若平衡时H2O的转化率为$\frac{1}{3}$,则b=3c,
又因为$\frac{c×c}{(a-c)(b-c)}=1$,
解得b=2a,由此分析解答;
④实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,所以Qc=1=K;
(3)①将100mL0.1mol/LNa2CO3的溶液溶质的物质的量为:0.1L×0.1mol/L=0.01mol,112mLCO2的物质的量为:0.005mol,发生反应Na2CO3+CO2+H2O=2NaHCO3,二者反应碳酸钠过量为0.005mol,同时生成0.01mol的NaHCO3,碳酸根离子的水解程度大于碳酸氢根离子,由此分析各离子的浓度;
②当往溶液中加入一定量的酸时碳酸钠结合氢离子而加碱时碳酸氢根离子与氢氧根离子反应,所以溶液的酸碱性基本不变.
解答 解:(1)反应热等于反应物总键能减去生成物的总键能,而二氧化碳与氢气反应生成甲醇的反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),可知该反应的反应热△H=(2×745+3×436-2×462.8-3×413.4-351-462.8)kJ•mol-1=-181.6kJ•mol-1,由图可知:△H=E1-E2,所以E2=E1-△H=8.2kJ•mol-1+181.6kJ•mol-1=189.8kJ•mol-1,故答案为:198.8;(2)①<;②1;③0.5,c=b/3;④=
(3)①c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);②向反应后的溶液中加入少量酸时,碳酸根结合氢离子转化为碳酸氢根,溶液的pH变化不大;加入少量碱时,碳酸氢根结合氢氧根转化为碳酸根,溶液的pH变化也不大
(2)①650℃根据方程式可知
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol)4 2 0 0
转化量(mol)1.6 1.6 1.6 1.6
平衡量(mol)2.4 0.4 1.6 1.6
因为两的计量数相等,所以反应前后体积不变,可以用物质的量代替浓度计算平衡常数,则该反应的平衡常数为K=$\frac{1.6×1.6}{2.4×0.4}$=$\frac{8}{3}$;
900℃根据方程式可知
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol)2 1 0 0
转化量(mol)$\frac{2}{3}$ $\frac{2}{3}$ $\frac{2}{3}$ $\frac{2}{3}$
平衡量(mol)$\frac{4}{3}$ $\frac{1}{3}$ $\frac{2}{3}$ $\frac{2}{3}$
此时平衡常数K=$\frac{\frac{2}{3}×\frac{2}{3}}{\frac{4}{3}×\frac{1}{3}}$=1,而$\frac{8}{3}$>1,这说明升高温度平衡常数减小,因此升高温度平衡向逆反应方向进行,即正反应是放热反应,则该反应的△H<0,故答案为:<;
②根据以上分析可知实验2条件下的平衡常数K=1,故答案为:1;
③实验3中,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol)a b 0 0
转化量(mol)c c c c
平衡量(mol)a-c b-c c c
若平衡时H2O的转化率为$\frac{1}{3}$,则b=3c,
又因为$\frac{c×c}{(a-c)(b-c)}=1$,
解得b=2a,即$\frac{a}{b}$=0.5,c=$\frac{b}{3}$,故答案为:0.5;$\frac{b}{3}$;
④实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时浓度熵Qc=1=K,因此反应恰好是平衡状态,则V正=V逆,故答案为:=;
(3)①将100mL0.1mol/LNa2CO3的溶液溶质的物质的量为:0.1L×0.1mol/L=0.01mol,112mLCO2的物质的量为:0.005mol,发生反应Na2CO3+CO2+H2O=2NaHCO3,二者反应碳酸钠过量为0.005mol,同时生成0.01mol的NaHCO3,碳酸根离子的水解程度大于碳酸氢根离子,所以离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
②当往溶液中加入一定量的酸时碳酸钠结合氢离子而加碱时碳酸氢根离子与氢氧根离子反应,所以溶液的酸碱性基本不变,故答案为:如果向反应后的溶液中加入少量的酸时,碳酸根结合氢离子转化为碳酸氢根,溶液的PH变化不大,如果加入少量的碱时,碳酸氢根结合氢氧根转化为碳酸根,溶液的PH变化也不大,因此反应后溶液可以作缓冲液.
点评 考查反应热、平衡常数计算、外界条件对平衡状态的影响以及溶液中离子浓度大小比较等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡C-CH2CH3 | B. | CH3C≡CH | C. | CH3CH2CH═CH2 | D. | CH2═CH-CH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
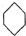 (g)?3H2(g)+
(g)?3H2(g)+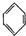 (g)△H1
(g)△H1 (g)+H2(g)→
(g)+H2(g)→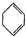 (g)△H2=+28.6KJ/mol
(g)△H2=+28.6KJ/mol (g)+2H2(g)→
(g)+2H2(g)→ (g)△H3=-237KJ•mol-1
(g)△H3=-237KJ•mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴0.1mol/L FeCl3溶液 | ①白色沉淀转化为红褐色沉淀 |
| Ⅱ | 4mL 2 mol/L NH4Cl 溶液 | ②白色沉淀溶解,得无色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
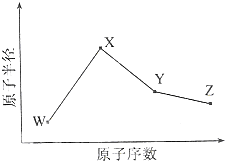 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCO3与盐酸反应:CO32-+2H+=CO2↑+2H2O | |
| B. | FeBr2与少量的Cl2反应:Fe2++Cl2=Fe3++2Cl- | |
| C. | 镁与醋酸反应 Mg+2H+=Mg2++H2↑ | |
| D. | NaHCO3与NaOH反应:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,1.7gH2O2中含有的电子数为0.9nA | |
| B. | 1L1 mol.L-1CuCl2溶液含有2nA个Cl- | |
| C. | 1 mol Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去2nA个电子 | |
| D. | 标准状况下,2.24L戊烷所含分子数为0.1nA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com