
| A.还原性:As3->S2->Cl- |
| B.热稳定性:HCl>AsH3>HBr |
| C.原子半径:As>Cl>P |
| D.酸性:H3AsO4>H2SO4>H3PO4 |
科目:高中化学 来源:不详 题型:单选题
| 12753 |
| 13153 |
| 12 |
| 13 |
| A.①⑥ | B.②③④ | C.⑤⑦ | D.②⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素周期表有七个横行,也是七个周期 |
| B.元素周期表有18个纵行,即有18个族 |
| C.短周期是指第一、二、三、四周期 |
| D.ⅠA族的元素全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.原子核内有8个中子的碳原子:
| ||
| B.1H2和2H2互为同位素 | ||
C.
| ||
D.硫原子的结构示意图: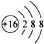 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
时间(h) 钾元素 温度熔出率 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 |
| B.在离原子核越近的区域运动的电子,能量越低 |
| C.1869年俄国化学家门捷列夫经研究提出了元素周期律,并列出了第一张元素周期表 |
| D.金刚石晶体中每个碳原子与相邻的三个碳原子以共价键结合,形成空间网状结构 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两类 | B.三类 | C.四类 | D.五类 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素的价电子数一定等于该元素的族序数 |
| B.主族元素原子的最高正价和负价的绝对值之和一定是8 |
| C.同一周期中,金属元素的原子半径大于非金属元素的原子半径 |
| D.短周期元素的原子或简单离子的电子层数一定等于周期序数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com