
| A. | 次氯酸可与碱反应 | B. | 次氯酸有漂白性 | ||
| C. | 次氯酸钙可与碳酸反应生成次氯酸 | D. | 次氯酸见光分解 |
分析 强弱电解质的根本区别是电离程度,完全电离的电解质是强电解质,部分电离的电解质是弱电解质,要想证明次氯酸是弱酸,只要能证明次氯酸部分电离即可,据此分析解答.
解答 解:A.次氯酸可以和碱反应,说明次氯酸属于酸,但不能说明次氯酸部分电离,所以不能证明次氯酸是弱酸,故A错误;
B.次氯酸具有漂白性,是因为其强氧化性性质,与其电离程度大小无关,所以不能证明次氯酸是弱酸,故B错误;
C.次氯酸钙能和碳酸反应,根据强酸制取弱酸原理知,次氯酸酸性小于碳酸,碳酸是弱酸,所以次氯酸是弱酸,故C正确;
D.次氯酸不稳定、见光易分解,说明次氯酸的稳定性强弱,不能证明次氯酸部分电离,所以不能说明次氯酸是弱酸,故D错误;
故选C.
点评 本题考查电解质强弱判断,为高频考点,明确强弱电解质根本区别是解本题关键,电解质强弱与电解质的溶解性、电解质溶液导电性强弱及稳定性等都无关,易错选项是D.


科目:高中化学 来源: 题型:选择题

| A. | 0~6 min内,反应的平均速率v(Cl2)=0.15 mol•L-1•min -1 | |
| B. | 若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡向正反应方向移动 | |
| C. | 随温度升高,该反应平衡常数减小;比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)>T(15) | |
| D. | 若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)=0.5 mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入过量Na2CO3溶液:Na+、Ca2+、NH4+、NO3-、H+ | |
| B. | 加入适量NaHCO3溶液:Na+、Ca2+、NH4+、NO3-、HCO3- | |
| C. | 加入适量NaOH溶液:Na+、Ca2+、NH4+、NO3-、OH- | |
| D. | 加入过量FeSO4和稀硫酸:Fe2+、Fe3+、NH4+、Ca2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| B. | 标准状况下,14 g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4 L任意比的氢气和氯气的混气中含有分子总数均为NA | |
| D. | 在标准状况下,18gH2O所含有的电子数不是10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
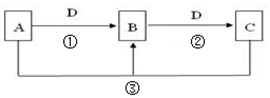 常见无机物A、B、C、D存在如图转化关系:
常见无机物A、B、C、D存在如图转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蘸浓盐酸的玻璃棒靠近盛放氨气的装置,检查是否漏气 | |
| B. | 浓硫酸沾在皮肤上,立刻用稀氢氧化钠溶液冲洗 | |
| C. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| D. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极发生氧化反应,其电极反应式:Ni2++2e-═Ni | |
| B. | 电解后,溶液中存在的金属阳离子只有Ni2+和Zn2+ | |
| C. | 电解后溶液中Ni2+数目减少 | |
| D. | 电解后,电解槽底部的阳极泥中有Pt和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
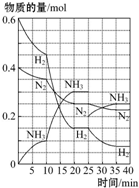 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A. | 反应开始到第一次平衡时,N2的平均反应速率为0.062 5 mol•L-1•min-1,H2的转化率为75% | |
| B. | 反应35 min时,达到第二次平衡时,反应的平衡常数:K=$\frac{0.1{5}^{2}}{0.07{5}^{3}•0.125}$ | |
| C. | 从曲线变化可以看出,反应进行到10~20 min时可能采取的措施是使用了催化剂 | |
| D. | 从曲线变化可以看出,反应进行至25 min时,采取的措施是分离出0.1 mol的氨气,平衡向正方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com