
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法不正确的是
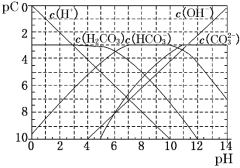
A.某温度下,CO2饱和溶液的浓度是0.05 molL-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为0.1% ,
B.25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6
C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32﹣)+c(OH﹣)+c(HCO3﹣)
D.25℃时,0.1 mol·L-1Na2CO3中c(HCO3﹣)比0.1 mol·L-1NaHCO3中c(HCO3﹣)大
【答案】CD
【解析】
试题分析:A.某温度下,CO2饱和溶液的浓度是0.05molL-1,其中![]() 的CO2转变为H2CO3,则H2CO3的浓度为0.01mol/L,电离度为
的CO2转变为H2CO3,则H2CO3的浓度为0.01mol/L,电离度为![]() ×100%=0.1%,故A正确;B.由图象可知当pH=6时,c(H+)=10-6mol/L,pC(H2CO3)=pC(HCO3-),Ka1(H2CO3)=
×100%=0.1%,故A正确;B.由图象可知当pH=6时,c(H+)=10-6mol/L,pC(H2CO3)=pC(HCO3-),Ka1(H2CO3)=![]() =10-6,故B正确;C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(HCO3-)+2c(CO32-),故C错误;D.碳酸根的水解程度大于碳酸氢根的水解程度,但水解程度都较小,25℃时,0.1 mol·L-1Na2CO3中c(HCO3﹣)比0.1 mol·L-1NaHCO3中c(HCO3﹣)小,故D错误;故选CD。
=10-6,故B正确;C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(HCO3-)+2c(CO32-),故C错误;D.碳酸根的水解程度大于碳酸氢根的水解程度,但水解程度都较小,25℃时,0.1 mol·L-1Na2CO3中c(HCO3﹣)比0.1 mol·L-1NaHCO3中c(HCO3﹣)小,故D错误;故选CD。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】向等体积、等pH的硫酸、盐酸和醋酸三种溶液中,分别滴加等浓度的NaOH溶液,至恰好完全反应,用去NaOH溶液的体积分别为V1、V2、V3,则三者的大小关系正确的是
A. V1<V2<V3 B. V1>V2=V3 C. V1=V2>V3 D. V1=V2<V3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是

A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干NaHCO3溶液制NaHCO3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m (n>2,m≤10)的实验流程如下:

已知:盐基度=![]() ×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
(1)实验加入硫酸的作用是____________,取样分析Fe2+浓度,其目的是___________。
(2)用pH试纸测定溶液pH的操作方法为____________,若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数____________(填“偏高”、“偏低”、“无影响”)
(3)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2][Fe2(OH)n(SO4)3-n/2]m,则水解反应的化学方程式为____________.
(4)产品盐基度的测定方法:
Ⅰ称取m g固体试样,置于400mL聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.
Ⅱ室温下放置10min,再加入10mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀.
Ⅲ加入5滴酚酞指示剂,立即用物质的量浓度为c molL-1的氢氧化钠标准液滴定至终点,消耗体积为VmL.
Ⅳ向聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0mL.
①达到滴定终点的现象为____________。
②已知试样中Fe3+的质量分数为a,则该试样的盐基度的计算表达式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于废弃塑料制品的处理方法中,最为恰当的是( )
A.将废弃物切成碎片,混在垃圾中填埋于土壤中
B.将废弃物焚烧
C.将废弃物倾倒在海洋中
D.将废弃物应用化学方法加工成防水涂料或汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于麻黄碱的说法错误的是( )
A.麻黄碱是国际奥委会严格禁止使用的兴奋剂
B.麻黄碱是从中药中提取的天然药物
C.麻黄碱能使人兴奋,运动员服用后能超水平发挥
D.麻黄碱有镇静催眠的效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将溶质的质量分数为10%的KOH溶液加热蒸发掉100g水后,得到溶质的质量分数为35%的溶液50mL,此时溶液的物质的量浓度为( )
A.5mol·L-1 B.3.25mol·L-1 C.7mol·L-1 D.6.25mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展“绿色食品”是提高人类生存质量,维护健康水平的重要措施。所谓“绿色食品”是指( )
A.绿颜色的营养食品 B.有叶绿素的营养食品
C.经济附加值高的食品 D.安全、无公害的食品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com