
【题目】某工业废液主要成分为SiO2、FeO、Fe2O3、Al2O3 等,为综合利用,对其进行如下处理,制备Al2O3及(NH4)2Fe(SO4)2·6H2O。

相关数据如下:
Kb(NH3·H2O) | 1.8×10-5 | 溶解度/g | 10℃ | 30℃ | 50℃ |
Ksp[A1(OH)3] | 1.3×10-33 | (NH4)2SO4 | 73.0 | 78.0 | 84.5 |
Ksp[Fe(OH)2] | 8.0×10-16 | FeSO4·7H2O | 40.0 | 60.0 | |
Ksp[Fe(OH)3] | 4.0×10-38 | |(NH4)2Fe(SO4)2·6H2O | 18.1 | 24.5 | 31.3 |
(1)酸浸过程中产生的滤渣的主要成分是_______________。
(2)滤液①中加入铁粉的作用是__________________。
(3)已知加入氨水前,溶液中H+、Fe2+、Al3+的浓度分别为0.02 mol/L、0.16mol/L、0.04mol/L,加人氨水后,溶液的体积刚好增加1倍。为防止Fe2+ 产生沉淀,则溶液中的pH不能超过_______,此时溶液中n(NH3·H2O):n(NH4+)≤_____________;若调节溶液pH为5,则溶液中所有离子的物质的量浓度由大到小排列的顺序是_________________。
(4)由滤液②制备(NH4)2Fe(SO4)2·6H2O 晶体时,为防止有(NH4)2SO4或FeSO4晶体析出,须先向滤液②中加人适量的______________,再蒸发浓缩、__________、过滤、__________、干燥。
【答案】 SiO2 将溶液中的Fe3+还原成Fe2+,使调节pH时只沉淀Al3+ 7 1∶180 c(SO![]() )>c(Fe2+)>c(NH)>c(H+)>c(Al3+)>c(OH-) (NH4)2SO4 冷却结晶 洗涤
)>c(Fe2+)>c(NH)>c(H+)>c(Al3+)>c(OH-) (NH4)2SO4 冷却结晶 洗涤
【解析】(1)SiO2不溶液于硫酸,故酸浸过程中产生的滤渣的主要成分是SiO2;(2)滤液①中加入铁粉的作用是将溶液中的Fe3+还原成Fe2+,使调节pH时只沉淀Al3+;(3)Ksp[Fe(OH)2]=c(Fe2+)c2(OH-)=![]() ×c2(OH-)= 8.0×10-16,则c(OH-)= 1.0×10-7mol/L,c(H+)= 1.0×10-7 mol/L,为防止Fe2+产生沉淀,则溶液中的pH不能超过7; Kb(NH3·H2O)=
×c2(OH-)= 8.0×10-16,则c(OH-)= 1.0×10-7mol/L,c(H+)= 1.0×10-7 mol/L,为防止Fe2+产生沉淀,则溶液中的pH不能超过7; Kb(NH3·H2O)=![]() =
=![]() =1.8×10-5,故c(NH4+):c(NH3·H2O)=180:1,此时溶液中n(NH3·H2O):n(NH4+)≤1:180;若调节溶液pH为5,则溶液中c(H+)= 1.0×10-5 mol/L,c(OH-)= 1.0×10-9mol/L,Al3+沉淀完全,c(Al3+) 1.0×10-5mol/L,已知加入氨水前,溶液中H+、Fe2+、Al3+的浓度分别为0.02mol/L、0.16mol/L、0.04mol/L,c(NH4+) =
=1.8×10-5,故c(NH4+):c(NH3·H2O)=180:1,此时溶液中n(NH3·H2O):n(NH4+)≤1:180;若调节溶液pH为5,则溶液中c(H+)= 1.0×10-5 mol/L,c(OH-)= 1.0×10-9mol/L,Al3+沉淀完全,c(Al3+) 1.0×10-5mol/L,已知加入氨水前,溶液中H+、Fe2+、Al3+的浓度分别为0.02mol/L、0.16mol/L、0.04mol/L,c(NH4+) =![]() +
+![]() =0.07mol/L,c(SO42-)=
=0.07mol/L,c(SO42-)=![]() =0.1125mol/L,c(Fe2+)=0.08mol/L,故所有离子的物质的量浓度由大到小排列的顺序是:c(SO42-)>c(Fe2+)>c(NH4+)>c(H+)>c(Al3+)>c(OH-);(4)由滤液②制备(NH4)2Fe(SO4)2·6H2O晶体时,为防止有(NH4)2SO4或FeSO4晶体析出,须先向滤液②中加人适量的(NH4)2SO4,再蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
=0.1125mol/L,c(Fe2+)=0.08mol/L,故所有离子的物质的量浓度由大到小排列的顺序是:c(SO42-)>c(Fe2+)>c(NH4+)>c(H+)>c(Al3+)>c(OH-);(4)由滤液②制备(NH4)2Fe(SO4)2·6H2O晶体时,为防止有(NH4)2SO4或FeSO4晶体析出,须先向滤液②中加人适量的(NH4)2SO4,再蒸发浓缩、冷却结晶、过滤、洗涤、干燥。


科目:高中化学 来源: 题型:
【题目】火箭使用偏二甲肼作燃料,四氧化二氮作氧化剂。引燃后产生的高温气体主要有CO2、H2O、NO、N2,但在卫星发射现场却看到火箭尾部喷出大量红烟,产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.CO2和NO反应生成NO2和CO
C.NO遇空气生成NO2
D.H2O和NO反应生成H2和NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液态化合物在一定量的氧气中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)=XO2(g)+2YO2(g)冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L.
(1)反应前O2的体积为 .
(2)化合物XY2的摩尔质量是 .
(3)在XY2分子中,X、Y两元素的质量之比为3:16,则X、Y两元素分别为和(写元素名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如下图所示,下列关于该有机物的说法正确的是

A. 该有机物催化加氢后的分子式为C10H18O
B. 分子中环上的碳原子可能在同一平面内部
C. 1mol该有机物能与1molNaOH反应
D. 该有机物中碳原子上的氢原子的一氯代物的同分异构体有7种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,配制一组c(H2A)+c(HA-)+c(A2-)=0.10mol·L-1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法正确的是

A. c(Na+)=0.10mol·L-1的溶液中,c(A2-)-c(H+)=c(H2A)-c(OH-)
B. pH=4的溶液中,c(HA-)=c(H2A)+c(A2-)
C. pH=7的溶液中,c(Na+)=c(A2-)+c(HA-)
D. K1(H2A)的数量级为10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,有报道说,喝了自制葡萄酒差点失明。主要原因是发酵过程产生的菌种多达百种,难以控制,而产生对神经有毒的甲醇等物质。科学酿酒加SO2等辅料。我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。
(1)葡萄酒中添加SO2的作用可能是________。
A.氧化细菌 B.抗氧化 C.漂白 D.增酸作用
I.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或HSO3。设计如图1的实验:
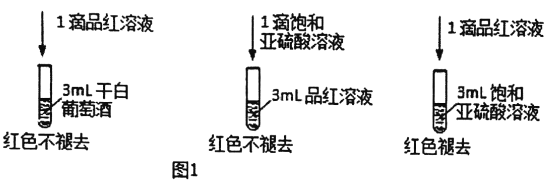
(2)甲同学得出实验结论: 干白葡萄酒中不含SO2或HSO3。这个结论是否合理?说明理由_________。
Ⅱ.实验方案二
如图2是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。

(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没瓶中固体,写出C装置反应的方程式______,每消耗1molNa2O2,则转移电子数___________。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,为了证明SO2有还原性,并从绿色化学的角度考虑,则Z试剂可以是___________,现象是___________。
Ⅲ.实验方案三
用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入图3 装置(电极均为惰性材料) 进行实验,可用于制备硫酸,同时获得电能:

(5)M极发生的电极反应式为__________。N极区溶液pH______(变大、变小、不变)。
(6)若使该装置的电流强度达到2.0A,理论上8 分钟应向负极通入标准状况下气体的体积为___L (已知: 1个e所带电量为1.6×10-19C,阿伏伽德罗常数6×1023)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E、M、N、Q都是短周期元素,其原子序数依次增大。E原子核内仅含有1个质子;M原子的最外层电子数是次外层的3倍;N的原子半径是短周期元素中最大的;N与Q能够形成NQ型离子化合物。下列说法错误的是
A. 四种元素中只有一种是金属元素 B. Q的最高化合价为+7
C. N的最高价氧化物对应的水化物是一种强碱 D. 离子半径:M<N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com