
化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不存在此类情况的是
A.铁片与过量浓硝酸(常温) B.铜粉与过量浓硝酸(常温)
C.浓盐酸与过量MnO2(共热) D.浓硫酸与过量铜片(共热)
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:2014-2015学年四川省攀枝花市高三上学期第二次统考理综化学试卷(解析版) 题型:填空题
(15分)A、B、C、D、E、X六种元素的原子序数依次递增,A、B、C的基态原子中L层未成对电子数分别为3、2、1,D是短周期中原子半径最大的主族元素,E是主族元素且与X同周期,E与C可形成离子化合物,其晶胞结构如图所示。X位于元素周期表中第四周期ⅠB族。请回答下列问题:

(1)D单质晶体中原子的堆积方式为体心立方堆积,其配位数是 。DAB3中阴离子的立体构型是 。中学化学常见微粒中,与晶体D3AB4中阴离子互为等电子体的分子有 (任写一种)。
(2)X2+离子的电子排布式为______,X2+离子与水分子形成的配离子[X(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[X(H2O)2(Cl)2]具有极性的分子的结构__________。
(3)A元素分别能与硼、铝形成相同类型的晶体,但是A与硼形成晶体的熔点更高,其原因是 。
(4)AC3的沸点比氨的沸点低得多,原因是 。
(5)若E与C形成的晶体的密度为a g·cm-3,则晶胞的体积是_____ cm3 (用NA表示阿伏伽德罗常数的值,写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
欲证明一瓶无色液体是纯水,可靠的实验方法是
A.测得其pH=7 B.电解时得到H2与O2的体积比为2:1
C.遇钠生成氢气 D.1.01× 105Pa时沸点为100℃
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
如图:甲为直流电源,乙为用含有酚酞的饱和食盐水浸透的滤纸,丙为电镀槽。断开K后,发现乙上c点附近显红色;闭合K,可实现铁上镀锌,电路中通过0.002NA个电子。以下判断正确的是
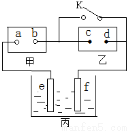
A.a为正极
B.d上发生还原反应
C.e为锌板
D.f的质量增加0.056 g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
实验室制取氯气并回收氯化锰,能达到该实验目的的装置是

A.用装置甲制取氯气 B.用装置丙分离二氧化锰和氯化锰溶液
C.用装置乙吸收制取氯气的尾气 D.用装置丁蒸干氯化锰溶液制 MnCl2·4H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
下列物质可用作食品添加剂的是
A.CH3OH B.CH3 CH2OH C.HCHO D.I2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:填空题
常温下有五种溶液:①NaHCO3 ;②KNO3;③ NH4HCO3;④ KOH;⑤ HCl
28.上述五种溶液中既能跟盐酸反应又能跟NaOH溶液反应的是 (填序号)。
上述①的水溶液呈碱性的原因是(用离子方程式表示) 。
29.取10mL 0.5mol/L⑤的溶液加水稀释到500mL,则该溶液中由水电离出的c(H+)= mol/L.  ③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
30.②和④混合后撒入铝粉,有气体产生,该气体能使湿润的红色石蕊试纸变蓝。
写出该反应化学方程式:_______________________________________________________。
31.最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变小,该反应 (选填编号)。 A.一定向正反应方向移动
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变小,该反应 (选填编号)。 A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
32.如果上述反应在体积不变的密闭容器中进行,当反应达到平衡后,下列判断错误的是
A.容器中气体的平均分子量不随时间而变化
B.通入大量稀有气体能提高反应的速率
C.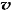 (N2)/
(N2)/  (O2)=2:3
(O2)=2:3
D.容器中气体的密度不随时间而变化
33.若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了0.18 g/L,在这段时间内O2的平均反应速率为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:选择题
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡已经发生移动的是
A.反应混合物的浓度 B.反应物的转化率
C.正、逆反应速率 D.反应混合物的压强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:填空题
(本题共12分)大约100年前,德国化学家哈伯(F.Haber)开始研究由氮气和氢气合成氨。一种工业合成氨的简易流程图如下:
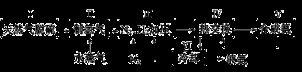
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________________________。
29.工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化含某些杂质的原料氢气。已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27。R原子核外电子有_____种不同运动状态,最外层的p电子有_______种自旋方向。
30.常温下,不能与M单质发生反应的是_________(填序号)
A.CuSO4溶液
B.Fe2O3
C.浓硫酸
D.NaOH溶液
E.Na2CO3固体
步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)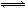 CO(g)+3H2(g)- 206.4 kJ
CO(g)+3H2(g)- 206.4 kJ
②CO(g)+H2O(g)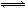 CO2(g)+H2(g)+ 41.2 kJ
CO2(g)+H2(g)+ 41.2 kJ
31.对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 。
A.升高温度 B.增大水蒸气浓度 C.加入催化剂 D.降低压强
32.利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________。
33.依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com