
【题目】研究不同 pH 时 CuSO4 溶液对 H2O2 分解的催化作用。资料:a.Cu2O 为红色固体,难溶于水,能溶于硫酸,生成 Cu 和Cu2+。b.CuO2 为棕褐色固体,难溶于水,能溶于硫酸,生成 Cu2+和 H2O2。c.H2O2 有弱酸性:H2O2 ![]() H+ +HO2-,HO2-
H+ +HO2-,HO2- ![]() H+ +O22-。
H+ +O22-。
编号 | 实验 | 现象 |
Ⅰ | 向 1 mL pH=2 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 出现少量气泡 |
Ⅱ | 向 1 mL pH=3 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生少量棕黄色沉淀,出现较明显气泡 |
Ⅲ | 向 1 mL pH=5 的 1 mol·L 1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生大量棕褐色沉淀,产生大量气泡 |
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是__。
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为 CuO2,其反应的离子方程式是__。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是__。
③为探究沉淀中是否存在 Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取 a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加 c mol·L 1EDTA 溶液至滴定终点,消耗 EDTA 溶液 V mL。V=__,可知沉淀中不含 Cu2O,假设ⅰ成立。(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96 g·mol 1,M(Cu2O)=144 g·mol1)
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因__ 。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pH=2、3、5 的 1 mol·L1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ:__(填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是__。
【答案】2H2O2 ![]() O2↑+2H2O H2O2+Cu2+=CuO2↓+2H+ CuO2与H+反应产生的H2O2具有强氧化性,在酸性条件下可能会氧化Cu2O或Cu,无法观察到红色沉淀Cu
O2↑+2H2O H2O2+Cu2+=CuO2↓+2H+ CuO2与H+反应产生的H2O2具有强氧化性,在酸性条件下可能会氧化Cu2O或Cu,无法观察到红色沉淀Cu ![]() 溶液中存在H2O2
溶液中存在H2O2![]() H+ +HO2-,HO2-
H+ +HO2-,HO2-![]() H+ +O22-,溶液pH增大,两个平衡均正向移动,O22-浓度增大,使得CuO2沉淀量增大 将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变 CuO2的催化能力强于Cu2+;随pH增大,Cu2+与H2O2反应生成CuO2增多
H+ +O22-,溶液pH增大,两个平衡均正向移动,O22-浓度增大,使得CuO2沉淀量增大 将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变 CuO2的催化能力强于Cu2+;随pH增大,Cu2+与H2O2反应生成CuO2增多
【解析】
(1)由题意可知,在硫酸铜做催化剂作用下,双氧水分解生成水和氧气,反应的化学方程式为2H2O2 ![]() O2↑+2H2O,故答案为:2H2O2
O2↑+2H2O,故答案为:2H2O2 ![]() O2↑+2H2O;
O2↑+2H2O;
(2)①若Ⅲ中生成的沉淀为CuO2,说明双氧水与铜离子反应生成过氧化铜和水,反应的离子方程式为H2O2+Cu2+=CuO2↓+2H+,故答案为:H2O2+Cu2+=CuO2↓+2H+;
②由题意可知,过氧化铜能与溶液中氢离子反应生成双氧水,双氧水具有强氧化性,在酸性条件下可能会氧化氧化亚铜或铜,无法观察到红色沉淀,说明假设ⅱ可能成立,乙同学的观点正确,故答案为:CuO2与H+反应产生的H2O2具有强氧化性,在酸性条件下可能会氧化Cu2O或Cu,无法观察到红色沉淀Cu;
③a g过氧化铜的物质的量为![]() ,由方程式可得如下关系:CuO2—Cu2+—EDTA,则有
,由方程式可得如下关系:CuO2—Cu2+—EDTA,则有![]() = c mol/L×V×10—3L,解得V=
= c mol/L×V×10—3L,解得V=![]() ml,故答案为:
ml,故答案为:![]() ;
;
(3)由题意可知,双氧水溶液中存在如下电离平衡H2O2![]() H+ +HO2-、HO2-
H+ +HO2-、HO2-![]() H+ +O22-,溶液pH增大,氢离子浓度减小,两个平衡均正向移动,过氧根浓度增大,使得过氧化铜沉淀量增大,故答案为:溶液中存在H2O2
H+ +O22-,溶液pH增大,氢离子浓度减小,两个平衡均正向移动,过氧根浓度增大,使得过氧化铜沉淀量增大,故答案为:溶液中存在H2O2![]() H+ +HO2-,HO2-
H+ +HO2-,HO2-![]() H+ +O22-,溶液pH增大,两个平衡均正向移动,O22-浓度增大,使得CuO2沉淀量增大;
H+ +O22-,溶液pH增大,两个平衡均正向移动,O22-浓度增大,使得CuO2沉淀量增大;
(4)若过氧化铜能够催化过氧化氢分解,过氧化氢分解速率加快,催化剂过氧化铜的组成和质量不会发生变化,则实验操作和现象为将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变,故答案为:将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变;
(5)由以上实验可知,当溶液pH增大时,双氧水溶液中过氧根浓度增大,使得过氧化铜沉淀量增大,过氧化铜的催化能力强于铜离子,使双氧水的分解速率增大,故答案为:CuO2的催化能力强于Cu2+;随pH增大,Cu2+与H2O2反应生成CuO2增多。


科目:高中化学 来源: 题型:
【题目】某同学在实验报告中记录下列数据,其中正确的是
A. 用 100 mL 量筒量取 12.5 mL 盐酸
B. 称量 NaOH 固体时,将 NaOH 直接放在托盘上的纸上
C. 需用 220 mL, 1 mol·L-1 CuSO4 溶液,配制时需称 62.5g 的 CuSO4·5H2O 晶体
D. 配制稀硫酸时,先向烧杯中注入浓硫酸,再加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向盛有某盐溶液的试管中滴入氢氧化钠溶液后,加热,试管口处湿润的红色石蕊试纸变蓝 | 该盐中含 |
B | 向溴水中通入某无色气体,溴水褪色 | 该气体可能是CH2=CH2 |
C | 一定量的铜与硝酸充分反应后,有铜剩余,再加入少量稀硫酸,铜继续溶解,并有气泡放出 | Cu与稀硫酸发生了反应 |
D | 向淀粉溶液中加少量稀硫酸,加热4~5min。冷却后向其中加入新制Cu(OH)2悬浊液,加热至沸腾,无砖红色沉淀 | 淀粉没有发生水解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3 是合成其他含钴配合物的重要原料。在活性炭的催化作用下,通过氧化二氯化六氨合钴(II)得到三氯化六氨合钴(III)制备流程如下:
![]()
资料:
①钴离子常见价态有+2(II)价,+3(III)价,Co(II)离子能在水溶液中稳定存在,但 Co(III)离子不能稳定存在,只能以固态或络合物形式(如[Co(NH3)6]3+)稳定存在溶液中。
② Co2+在 pH=9.4 时完全沉淀为 Co(OH)2
(1) 实验中需要将 CoCl2·6H2O 晶体研细,其目的是:__________________。
(2)在加入浓氨水前先加入大量 NH4Cl溶液,请结合平衡原理解释原因______________________。
(3)在“氧化”过程中需水浴控温在 50~60℃,温度不能过高,原因是______________________。
(4)写出“氧化”过程中反应的离子方程式_______________。
(5)为测定产品中钴的含量,进行下列实验:
①称取样品 4.000 g 于烧瓶中,加水溶解,加入足量的 NaOH 溶液,加热至沸 15~20 min,将 [Co(NH3)6]Cl3 完全转化为 Co(OH)3,冷却后加入足量 KI 固体和 HCl 溶液,充分反应一段时间后,将烧瓶中的溶液全部转移至 250.00 mL 容量瓶中,加水定容,取其中 25.00 mL 试样加入到锥形瓶中;
②用 0.100 0 mol·L -1 Na2S2O3 标准溶液滴定,溶液变为浅黄色后,加入淀粉溶液作指示剂继续滴定至终点,重复 2 次实验,测得消耗 Na2S2O3 溶液的平均体积为 15.00 mL。(已知:2Co3++2I-=2Co2++I2 ,I2 +2S2O32-=2I-+S4O62-).通过计算确定该产品中钴的含量___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式。
C6H12O6(葡萄糖)![]() 2________+2C2H5OH
2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是________________________________。
②试管b中盛放的试剂是饱和_________________溶液。
⑧实验开始时,试管b中的导管不伸入液面下的原因是___________________。
④若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单萜类化合物香叶醇是香精油的主要成分之一。在酸性溶液中,香叶醇可以转化为环状单萜α—松油醇:
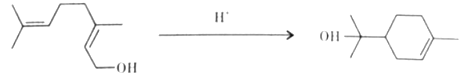
关于香叶醇和α—松油醇,下列说法正确的是( )
A.两者互为同分异构体,分子式是C10H20O
B.两者分子中所有碳原子均处于同一平面
C.两者均能在铜丝催化下和氧气氧化生成醛
D.两者均能使溴的四氯化碳溶液褪色,发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仪器保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)和PVDC.其中PE和PVDC是安全的,PVC对人体有潜在危害.工业上用乙烯和氯气为主要原料来合成上述三种物质。
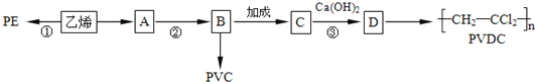
完成下列填空:
(1)A的名称__;反应①的类型__;
(2)反应②的反应条件__;D的同分异构体的结构简式__;
(3)反应③的化学方程式_______;
(4)反应②中有多种副反应,得到的有机副产品除了CH3CHO和![]() 外,还可能有_______。
外,还可能有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a 、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近均有气泡产生;铜珠n的右侧有气泡产生。 |
下列对实验现象的解释或推测不合理的是( )
A. 根据实验一的原理,实验二中铜珠m左侧变厚
B. a、d处:2H2O+2e-=H2↑+2OH-
C. b处:2Cl--2e-=Cl2↑;Cl2 + H2O =HCl + HClO
D. c处发生了反应:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代陶瓷烧制工艺的珍品“唐三彩”中的蓝色,其釉料的着色剂是一种含钴矿物。钴在制取颜料和制备合金方面有着重要的应用,回答下列问题。
(1)基态Co2+的核外电子排布式为__________,基态Co原子中空间运动状态不同的电子数为___种。
(2)配合物[Co(NH3)5Br](NO3)2中存在的化学键类型有__________,配体NH3中配位原子的杂化轨道类型为__________,NO3-的空间构型是__________,第一电离能N__________(填“大于”或“小于”)O。
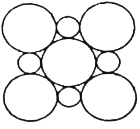
(3)CoO2具有如图所示的层状结构(小球表示Co,大球表示O)。下列用粗实线画出的结构单元不能描述其化学组成的是__________(填字时代号)。
A.  B.
B. 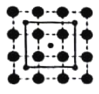 C.
C. 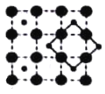 D.
D. 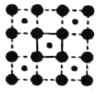
(4)MgO具有NaCl型结构(示意图如图所示),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________ nm(结果保留三位小数,下同)。CoO也属于NaCl型结构,晶胞参数为a'=0.488 nm,则r(Co2+)为________ nm
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com