
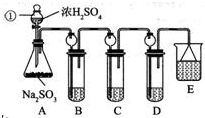
分析 探究SO2的化学性质:A装置制取二氧化硫,装置B检验SO2的氧化性,装置C检验SO2的还原性,装置D探究二氧化硫和氢氧化钙反应生成白色沉淀成分.
(1)依据实验室常用仪器的名称结合在实验中的作用进行解答;
(2)根据装置气密性检验的原理解答;
(3)根据氧化还原反应的规律,元素化合价降低发生还原反应,具有氧化性,据此解答;
(4)氧化还原反应Br2+SO2+2H2O═2HBr+H2SO4中,Br2在反应中做氧化剂,具有氧化性,被还原,根据离子方程式的书写方法书写离子反应方程式,据此解答;
(5)①新制漂白粉浓溶液中含有的次氯酸根离子具有氧化性,能氧化亚硫酸根离子;
②因沉淀的表面有可溶性的杂质,需用蒸馏水重复洗涤;亚硫酸钙和盐酸反应生成二氧化硫,二氧化硫具有漂白性,可使品红褪色;
③漂白粉浓溶液中含有的次氯酸根离子具有氧化性,能氧化+4价的硫,据此书写化学方程式;
(6)根据NaOH溶液吸收SO2和防倒吸的原理进行解答.
解答 解:(1)仪器①是常用的仪器分液漏斗,能在装置中起到加入液体药品的作用,并能控制液体流量,从而控制反应的速率,
故答案为:分液漏斗;
(2)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏,所以检查装置A的气密性的操作为关闭分液漏斗活塞,将导管末端插入B试管水中,用手捂住锥形瓶,若在导管口有气泡冒出,松开手后导管中上升一段水柱,则表明装置A气密性良好,
故答案为:关闭分液漏斗活塞,将导管末端插入B试管水中,用手捂住锥形瓶,若在导管口有气泡冒出,松开手后导管中上升一段水柱,则表明装置A气密性良好;
(3)硫化氢水溶液或硫化钠、硫氢化钠溶液中的硫元素都为-2价,与二氧化硫反应,化合价会升高,被氧化二氧化硫表现氧化性,如:2H2S+SO2=3S+2H2O中,H2S中S元素的化合价升高,被氧化,SO2中S元素的化合价降低,被还原,SO2为氧化剂,
故答案为:硫化氢水溶液(或硫化钠、硫氢化钠溶液);
(4)在反应Br2+SO2+2H2O═2HBr+H2SO4中,Br元素的化合价由0降低为-1价,则Br2为氧化剂,在反应中表现氧化性,S元素的化合价+4价升高+6价,则SO2为还原剂,在反应中被氧化,在离子反应方程式中,单质和氧化物写化学式,所以离子方程式为:SO2+Br2+2H2O=SO42-+4H++2Br-;
故答案为:还原;SO2+Br2+2H2O=SO42-+4H++2Br-;
(5)①新制漂白粉浓溶液中含有的次氯酸根离子具有强氧化性,二氧化硫具有还原性,会发生氧化还原反应,生成产物为硫酸钙,
故答案为:CaSO4;
②白色沉淀表面有钙离子和氯离子、硫酸根离子等可溶性的离子,需除去这些离子,方法是沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水流尽后重复2~3次以上操作;亚硫酸钙和盐酸反应CaSO3+2HCl═CaCl2+SO2↑+H2O,二氧化硫与品红化合生成无色物质,能使品红溶液褪色;
故答案为:沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水流尽后重复2到3次以上操作;过量(或适量)0.5 mol•L-1HCl; 品红溶液; 若固体完全溶解,有气泡产生,且能使品红溶液褪色;
③漂白粉浓溶液中含有的次氯酸根离子具有氧化性,能氧化+4价的硫,所以生成该白色沉淀的化学方程式:Ca(ClO)2+H2O+SO2=CaSO4+2HCl,
故答案为:Ca(ClO)2+H2O+SO2=CaSO4+2HCl;
(6)二氧化硫是有毒的气体,是大气污染物,所以装置E的作用是吸收二氧化硫防止造成空气污染,可用氢氧化钠,氢氧化钠和二氧化硫反应2NaOH+SO2═Na2SO3+H2O,为防止倒吸用倒扣的漏斗,
故答案为:NaOH溶液;吸收SO2,防止造成空气污染.
点评 本题主要考查了探究SO2的化学性质实验操作,掌握实验的原理及二氧化硫的性质是解题的关键,题目难度中等.


 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥 | |
| B. | N2+3H2$?_{高温、高压}^{催化剂}$2NH3,用烧碱进行干燥 | |
| C. | 加热浓氨水,气体用碱石灰干燥 | |
| D. | 加热NH4HCO3,气体用P2O5干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
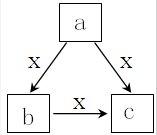 X为一种常见气体(常温下),a,b,c是中学化学常见物质,均由常见元素组成,转化关系如图所示,下列说法不正确的是( )
X为一种常见气体(常温下),a,b,c是中学化学常见物质,均由常见元素组成,转化关系如图所示,下列说法不正确的是( )| A. | 若a、b、c焰色反应均呈黄色,其水溶液均为碱性,则a中可能既含有离子键又含有共价键 | |
| B. | 若X为O2,a为一种固态单质,则c可能为CO2或SO2 | |
| C. | 若b为固态非金属单质,X为气体单质,且b与X所含元素同主族,则a→b、b→c、a→c的反应均为氧化还原反应 | |
| D. | 若a、b、c均含有同一种非金属,且X的水溶液呈碱性,则c可能受热易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验目的 | 操作或现象 |
| A | 检验甲酸溶液中是否含有甲醛 | 向溶液中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,有红色沉淀产生 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验蔗糖是否已水解 | 向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟,冷却,再加入银氨溶液,水浴加热 |
| D | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向上层清液中加稀HNO3酸化,再滴加AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 一定条件下6.4g S02与足量氧气反应生成S03,转移电子数小于0.2 NA | |
| C. | lmol羟基(一OH)与17gNH3所含电子数都为NA | |
| D. | 适量铜粉溶解于1 L 0.5mol/L稀硝酸中,当生成2.24 L NO时,溶液中氮原子数0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2 mol SO3含有的氧原子数为6NA | |
| B. | 一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32-)=1 mol/L,则Na+个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1 L溶液,所得溶液中Na+的浓度为1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com