

分析 (1)①原电池中阳离子向正极移动;
②充电时,阳极上LiFePO4失电子发生氧化反应;
(2)根据图示可知反应物为MgH2、LiBH4,生成物为LiH、MgB2、H2,根据原子守恒书写化学方程式;
(3)根据1g固态镁在CO2气体中完全燃烧放出4.3kJ的热量,计算2mol镁燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;(4)①氢氧化镁为碱,亚硫酸为二元弱酸,但其二级电离大于其水解;
②脱除烟气中的SO2最终转化为MgSO4,需有Mg(OH)2,当溶液中Mg(OH)2耗尽,脱硫效率开始急速降低;
③根据MgSO3的溶解度计算Ksp(MgSO3)与CaSO3比较分析解答.
解答 解:(1)①原电池中阳离子向正极移动,则锂离子电池放电时,Li+向正极迁移,
故答案为:Li+;
②根据图示可知,充电时,阳极的电极上LiFePO4失电子,电极反应式为:LiFePO4-xe-═xLi++Li1-xFePO4,
故答案为:LiFePO4-xe-═xLi++Li1-xFePO4;
(2)纳米MgH2和LiBH4组成的体系制取氢气,根据图示可知反应物为MgH2、LiBH4,生成物为LiH、MgB2、H2,反应方程式为:MgH2+2LiBH4=2LiH+MgB2+4H2↑,
故答案为:MgH2+2LiBH4=2LiH+MgB2+4H2↑;
(3)Mg在CO2气体中完全燃烧反应的化学方程式为:2Mg+CO2=2MgO+C,1g固态镁在CO2气体中完全燃烧放出4.3kJ的热量,则2molMg在CO2气体中完全燃烧放出的热量为:4.3kJ×24×2=206.4KJ,所以该反应的热化学方程式为2Mg(S)+CO2(g)=2MgO(S)+C(S)△=-206.4kJ/mol,
故答案为:2Mg(S)+CO2(g)=2MgO(S)+C(S)△=-206.4kJ/mol;
(4)①用MgO浆液脱硫发生Ⅰ、Ⅱ、Ⅲ、Ⅳ四个反应,Mg(HSO3)2电离大于其水解,溶液呈酸性,脱硫过程中使浆液pH减小最显著的反应是ⅡMgSO3+SO2+H2O═Mg(HSO3)2,
故答案为:Ⅱ;
②根据用MgO浆液脱硫发生Ⅰ、Ⅱ、Ⅲ、Ⅳ四个反应可知,当当溶液中Mg(OH)2耗尽,脱硫效率开始急速降低,
故答案为:溶液中Mg(OH)2已经耗尽;
③MgSO3的溶解度为0.646g/l00gH2O,溶液中c(Mg2+)≈0.062115mol/L,Ksp=c(SO32-)•c(Mg2+)≈3.86×10-3>(CaSO3)=3.1×10-7,MgSO3溶解度比CaSO3大,MgSO3比CaSO3更易被氧化,
故答案为:MgSO3溶解度比CaSO3大,MgSO3比CaSO3更易被氧化.
点评 本题为盐城市2017届高三第三次调研考试题,侧重考查了电化学、化学反应中能量变化、沉淀溶解平衡等知识,难点为在给定的文献图表中提取有价值的信息,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲的体积比乙的体积大 | B. | 甲的分子数比乙的分子致少 | ||
| C. | 甲的压强比乙的压强大 | D. | 甲的摩尔体积比乙的华尔体积大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

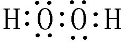 ,用电子式表示Y的形成过程
,用电子式表示Y的形成过程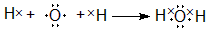 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1735Cl与1737Cl得电子能力相同 | |
| B. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹(At)为有色固体,HAt不稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com