
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |

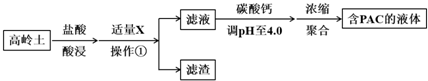
分析 高岭土的主要化学组成为Al2O3、SiO2、Fe2O3,由制备流程可知,加盐酸发生6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O,加X可调节pH使铁离子转化为沉淀,则过滤后的滤渣为SiO2、Fe(OH)3,滤液中含铝离子,用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低,最后浓缩、聚合得到聚合氯化铝(PAC),并结合习题中的信息及图象来解答.
解答 解:高岭土的主要化学组成为Al2O3、SiO2、Fe2O3,由制备流程可知,加盐酸发生6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O,加X可调节pH使铁离子转化为沉淀,则过滤后的滤渣为SiO2、Fe(OH)3,滤液中含铝离子,用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低,最后浓缩、聚合得到聚合氯化铝(PAC),
(1)盐酸酸浸所涉及反应的离子方程式是6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O,
故答案为:6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O;
(2)由表中数据可知加入X的主要目的调节溶液pH至Fe3+完全沉淀,由上述分析可知,滤渣中主要含有物质的化学式是Fe(OH)3、SiO2,
故答案为:调节溶液pH至Fe3+完全沉淀;Fe(OH)3、SiO2;
(3)用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低,解释pH偏小液体PAC产率降低的原因为pH偏小时,抑制平衡2Al3++m(6-n) Cl-+mn H2O?[Al2(OH)nCl6-n]m+mn H+ 正向移动生成PAC,
故答案为:pH偏小时,抑制平衡2Al3++m(6-n)Cl-+mn H2O?[Al2(OH)nCl6-n]m+mn H+ 正向移动生成PAC;
(4)①由图2可知,50-90℃之间制备的液体PAC中,聚合形态铝含量最多,故答案为:聚合;
②当T>80℃时,AlT明显降低的原因是温度升高,导致液体PAC向Al(OH)3沉淀转化,故答案为:温度升高,导致液体PAC向Al(OH)3沉淀转化.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程及习题中的表格、图象等为解答的关键,侧重分析与应用、实验能力的综合考查,题目难度中等.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质在水中存在沉淀溶解平衡,且是一种动态平衡 | |
| B. | Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和离子浓度无关 | |
| C. | 在一定温度下的BaSO4饱和溶液中加入少量BaCl2固体,BaSO4的Ksp减少 | |
| D. | 当阴、阳离子个数比相同时,难溶电解质的Ksp数值越大,溶解能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | KOH溶液的 浓度/mol•L-1 | 滴定完成时,KOH溶液滴入的体积/mL | 待测盐的体积/mL酸 |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
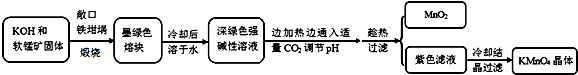
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
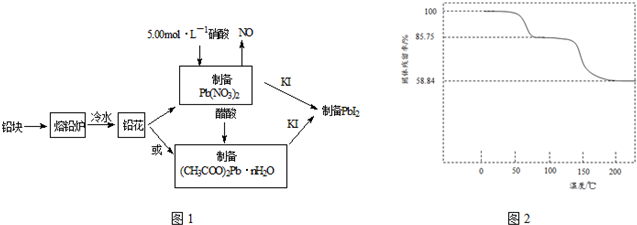
| 实验内容 | 实验方法 | 实验现象及原因分析 |
| ①磺离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
| ②铅离子浓度减小对平衡的影响 | 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 | 现象:黄色浑浊消失 原因:形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于PbI2的Ksp |
| ③铅离子和碘离子浓度都减小对平衡的影响 | 在PbI2悬浊液中滴入几滴FeCl3 饱和溶液 | 现象:黄色浑浊消失 写出反应的离子方程式: PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
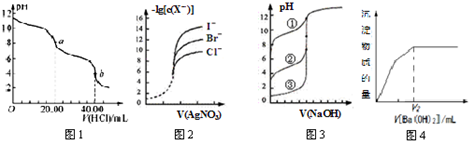
| A. | 图1是用0.l000 mol•L-1的盐酸滴定20.00 mL 0.l000mol•L-1Na2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+=CO2↑+H2O | |
| B. | 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- | |
| C. | 用0.1000 mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图3曲线确定①的酸性最强 | |
| D. | 图Ⅳ表示明矾中滴入Ba(OH)2溶液,图中的V2表示生成的氢氧化铝恰好溶解时加入Ba(OH)2溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
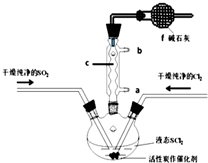 SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 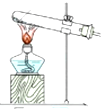 |  | 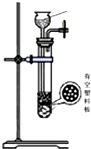 | 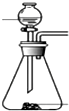 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO | 70%H2SO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
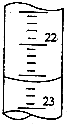 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com