
 用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.分析 (1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,消毒效率分别为$\frac{m}{67.5}$×5、$\frac{m}{166}$×3、$\frac{m}{71}$×2×1;
(2)①根据反应物和产物结合原子守恒来书写方程式;二氧化氯的沸点低,B装置应降低温度;
②C装置不能用橡皮塞堵住瓶口;
③C为尾气吸收装置,可选择碱来吸收尾气,发生氧化还原反应生成氯酸钠和亚氯酸钠,根据电子得失守恒以及原子守恒配平;配制450mL 4mol/L的NaOH溶液,应选择500mL容量瓶,结合m=cVM计算;根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器.
解答 解:(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率分别为$\frac{m}{67.5}$×5、$\frac{m}{166}$×3、$\frac{m}{71}$×2×1,所以由大到小的顺序为ClO2>Cl2>Na2FeO4;
故答案为:ClO2;Cl2;Na2FeO4;
(2)①加热60℃,氯酸钾和草酸反应生成碳酸钾、二氧化碳、二氧化氯和水,反应方程式为:2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O;二氧化氯的沸点低,B装置应降低温度,补充冷凝装置;
故答案为:2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O;盛有冰水混合物的水槽;
②C装置不能用橡皮塞堵住瓶口,否则没有使瓶内外压强相等,气体不能顺利通过,
故答案为:C;仪器C没有使瓶内外压强相等,气体不能顺利通过;
③C为尾气吸收装置,可选择NaOH溶液来吸收尾气,发生氧化还原反应为:2ClO2+2NaOH═NaClO2+NaClO3+H2O,离子反应为:2ClO2+2OH-=ClO2-+ClO3-+H2O;
配制450mL 4mol/L的NaOH溶液,还需要500mL容量瓶、烧杯,需要NaOH的质量为0.5L×4mol/L×40g/mol=80.0g;
操作步骤有计算、称量、稀释、移液、洗涤移液、定容、摇匀等操作,用托盘天平称取氢氧化钠,在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.所以需要的仪器为:玻璃棒、烧杯、胶头滴管、托盘天平、500mL容量瓶,
故答案为:2ClO2+2OH-=ClO2-+ClO3-+H2O;80.0;500ml容量瓶;烧杯.
点评 本题以氯及其化合物的性质考查氧化还原反应及物质的制备,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1000mL,212g | B. | 950mL,201.4g | C. | 任意规格,212g | D. | 500mL,106g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,若要检验出其中的碳碳双键,方法是先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在.
,若要检验出其中的碳碳双键,方法是先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | --- |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
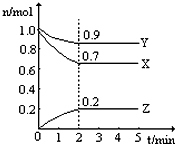 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:
甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:| 温度/℃ | T1 | T2 |
| K | 2.041 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NA个氢气分子所占的体积为22.4L | |
| B. | 2NA个二氧化碳分子的质量为44g | |
| C. | 1000mL0.1mol/L的NaCl溶液中,Na+和Cl-离子总数为0.2NA | |
| D. | 17g氨气中所含原子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁粉代替铁钉与稀盐酸反应 | |
| B. | 将食物由常温保存改为在冰箱中保存 | |
| C. | 加入MnO2粉末做H2O2分解反应的催化剂 | |
| D. | 用 3 mol/L 的盐酸代替 1 mol/L 的盐酸与锌粒反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com