
| A. | 聚丙烯的结构简式: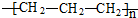 | B. | 丙烷分子的比例模型: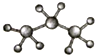 | ||
| C. | 四氯化碳分子的电子式: | D. | 乙酸乙酯的实验式:C2H4O |
科目:高中化学 来源: 题型:多选题
| 反应时间min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 增大压强对正逆反应速率没有影响,平衡不移动 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O(g),达到平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | |
| D. | 由表格中数据得出,t1时刻该反应还未达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| $\frac{P}{{P}_{0}}$ | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
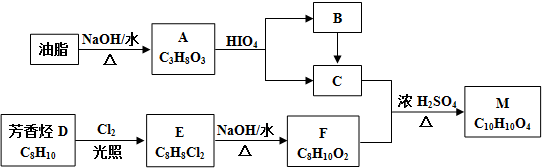
 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$  +
+
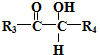 $\stackrel{HIO_{4}}{→}$R3COOH+
$\stackrel{HIO_{4}}{→}$R3COOH+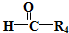
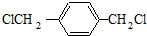 .
.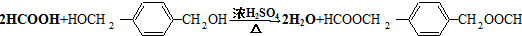 .
.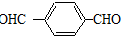
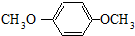

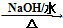 HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO
HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO 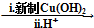 HCOOH
HCOOH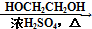 HCOOCH2CH2OOCH.
HCOOCH2CH2OOCH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④① | C. | ④③②① | D. | ②③①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)工业上用无水硫酸钠生产硫化钠的流程如下:
(1)工业上用无水硫酸钠生产硫化钠的流程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com