
| A. | 2:3 | B. | 3:2 | C. | 1:1 | D. | 2:1 |
分析 把氧化铁和铝粉配成铝热剂,分成两等份,一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n(H2)=3n(Al);另一份在高温下恰好完全反应生成铁与氧化铝,由电子转移守恒可知n(Fe)=n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子转移守恒可知n′(H2)=n(Fe),另据此计算判断.
解答 解:把氧化铁和铝粉配成铝热剂,分成两等份,一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al);另一份在高温下恰好完全反应生成铁与氧化铝,由电子转移守恒可知n(Fe)=n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子转移守恒可知n′(H2)=n(Fe),
相同条件下气体的体积之比等于其物质的量之比,
故两种情况下生成气体的物质的量之比为:n(H2):n′(H2)=$\frac{3}{2}$n(Al):n(Al)=3:2,
故选B..
点评 本题考查混合物反应的计算、根据方程式的计算,题目难度中等,本题采取电子转移守恒计算,比根据方程式简单容易,清楚反应过程是关键,注意混合物的计算中守恒的运用


科目:高中化学 来源: 题型:解答题
 ,ci2与ce2比较,沸点较高的是CS2(写分子式).
,ci2与ce2比较,沸点较高的是CS2(写分子式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺: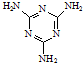 .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度越高,镁与水反应的速率越快 | |
| B. | 镁与水反应的化学方程式为:Mg+2H2O═Mg(OH)2+H2↑ | |
| C. | 氢氧化镁显碱性,且在水中有一定的溶解性 | |
| D. | 氢氧化镁是离子化合物,它的电子式可表示为: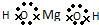 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该装置实现化学能向电能的转化 | |
| B. | 该电池的总反应为2NO+O2═2NO2 | |
| C. | NiO电极的电极反应式:NO+O2--2e-═NO2 | |
| D. | 当有2.24L的O2参与反应时,转移了0.4mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把钠放入足量稀盐酸中 | |
| B. | 将钠用铝箔包好并刺些小孔,再放入水中 | |
| C. | 把钠放入硫酸铜溶液中 | |
| D. | 把钠放入足量水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体在受热熔化过程中一定存在化学键的断裂 | |
| B. | 晶体的自范性是指在适宜条件下晶体能够自发地呈现规则的多面体外形 | |
| C. | 区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验 | |
| D. | 晶体的各向异性取决于微观粒子的排列具有特定的方向性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com