
 .②写出反应Ⅰ的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
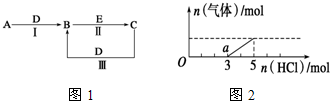
.②写出反应Ⅰ的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.分析 (1)A是能使湿的红色石蕊试纸变蓝的气体,为NH3;C、D均为空气的主要成分,为N2、O2,由转化关系A$\stackrel{D}{→}$B,故D为O2,B为NO,C为N2,E是一种有毒气体,结合转化关系NO$\stackrel{E}{→}$N2,E具有还原性,为CO,验证符合转化关系;
(2)A是淡黄色化合物,常见淡黄色固体化合物是过氧化钠和溴化银,常温下D是无色气体,A能和D反应,所以A是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),验证符合转化关系;
(3)将(2)中一定量的气体D为二氧化碳,通入2L C的溶液中,C是氢氧化钠,根据图象可知,氯化氢的物质的量在前3mol时没有气体,后面再加2mol时产生的气体,根据Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑知,Na2CO3转化为NaHCO3、NaHCO3转化为NaCl需要的HCl的物质的量相等,实际上Na2CO3需要的HCl大于NaHCO3,所以溶液中还存在NaOH,所以二氧化碳通入氢氧化钠溶液得到的溶液为氢氧化钠和碳酸钠的混合物,氯化氢的物质的量在前3mol时发生的反应为Na2CO3+HCl=NaHCO3+NaCl、NaOH+HCl=H2O+NaCl,在后2mol时发生的反应为NaHCO3+HCl=NaCl+H2O+CO2↑,据此进行计算.
解答 解:(1)A是能使湿的红色石蕊试纸变蓝的气体,为NH3;C、D均为空气的主要成分,为N2、O2,由转化关系A$\stackrel{D}{→}$B,故D为O2,B为NO,C为N2,E是一种有毒气体,结合转化关系NO$\stackrel{E}{→}$N2,E具有还原性,为CO,验证符合转化关系;
①C为N2,电子式为 ,
,
故答案为: ;
;
②故加热、催化剂条件下,氨气和氧气反应生成一氧化氮和水,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
③催化剂条件下,一氧化氮和一氧化碳反应生成二氧化碳和氮气,反应方程式为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(2)A是淡黄色化合物,常见淡黄色固体化合物是过氧化钠和溴化银,常温下D是无色气体,A能和D反应,所以A是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),验证符合转化关系.
①C是氢氧化钠,C中所含化学键的类型是离子键和共价键,
故答案为:离子键和共价键;
②过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2;
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)将(2)中一定量的气体D为二氧化碳,通入2L C的溶液中,C是氢氧化钠,根据图象可知,氯化氢的物质的量在前3mol时没有气体,后面再加2mol时产生的气体,根据Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑知,Na2CO3转化为NaHCO3、NaHCO3转化为NaCl需要的HCl的物质的量相等,实际上Na2CO3需要的HCl大于NaHCO3,所以溶液中还存在NaOH,所以二氧化碳通入氢氧化钠溶液得到的溶液为氢氧化钠和碳酸钠的混合物,氯化氢的物质的量在前3mol时发生的反应为Na2CO3+HCl=NaHCO3+NaCl、NaOH+HCl=H2O+NaCl,在后2mol时发生的反应为NaHCO3+HCl=NaCl+H2O+CO2↑,
①根据上面的分析可知,O点溶液中所含溶质的化学式为 NaOH、Na2CO3,
故答案为:NaOH、Na2CO3;
②根据上面的分析可知,a点时溶液中的溶质是NaHCO3和NaCl,氯化钠为强碱强酸盐,钠离子和氯离子不水解,NaHCO3为强碱弱酸酸式盐,其溶液呈碱性,则c(OH-)>c(H+),碳酸氢根离子水解程度大于电离程度,碳酸氢根离子电离生成碳酸根离子,水和碳酸氢根离子都电离生成氢离子,所以c(H+)>c(CO32-),根据元素守恒知c(Na+)>c(Cl-),根据图象知,NaOH需要HCl和碳酸钠需要HCl的物质的量之比为1:2,根据原子守恒知,生成氯化钠的物质的量和碳酸氢钠的物质的量之比为3:2,根据元素守恒知,溶液中离子浓度大小顺序是c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),当氯化氢的物质的量为5mol时,溶液中的溶质为氯化钠,根元素守恒可知,原溶液中的氢氧化钠的物质的量为5mol,所以氢氧化钠溶液的物质的量溶液为$\frac{5mol}{2L}$=2.5mol/l,
故答案为:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);2.5.
点评 本题以元素化合物的推断为载体考查了元素化合物的性质,同时考查学生分析问题、解决问题的能力,明确物质的性质是解本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaCl、Cl2 | B. | NaHCO3、蔗糖 | C. | Ba(OH)2、HCl | D. | H2SO4、盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅$→_{高温}^{氯气}$ SiCl4 $→_{高温}^{氢气}$Si | |
| B. | Mg(OH)2 $\stackrel{盐酸}{→}$ MgCl2(aq)$\stackrel{电解}{→}$ Mg | |
| C. | Fe2O3 $\stackrel{盐酸}{→}$ FeCl3(aq)$\stackrel{蒸发}{→}$ 无水FeCl3 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{加热}^{蔗糖}$ Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{3}$mol | B. | $\frac{4}{3}$mol | C. | 1mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 800mL0.5mol/L的NaCl溶液 | B. | 100mL0.3mol/L的AlCl3溶液 | ||
| C. | 500mL0.3mol/L的CaCl2溶液 | D. | 300mL0.3mol/L的MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
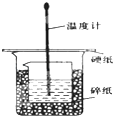 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如 图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如 图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4 •5H2O、磁性氧化物都是纯净物 | |
| B. | 一种物质不是电解质就是非电解质 | |
| C. | 稀硫酸、NaCl溶液是实验室常见的电解质 | |
| D. | 二氧化硫可广泛用于食品的增白 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com