
分析 反应速率之比等于化学计量数之比,则反应速率与化学计量数的比值越大,速率越大,以此来解答.
解答 解:反应速率与化学计量数的比值越大,速率越大,则
①中$\frac{0.015}{1}$=0.015;
②中$\frac{0.09}{3}$=0.03;
③中$\frac{\frac{2.4}{60}}{2}$=0.02;
④中$\frac{0.045}{3}$=0.015,
则反应速率的快慢顺序为②>③>①=④,
故答案为:②>③>①=④.
点评 本题考查反应速率的比较,为高频考点,把握反应速率与化学计量数的关系为解答的关键,侧重分析与应用能力的考查,注意比值法应用及速率单位,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol D2O分子所含的中子数为8NA | |
| B. | 48 g氧气和臭氧的混合气体中的氧原子数为3NA | |
| C. | 11.2 L 甲烷(CH4)中的共价键数为2NA | |
| D. | 1 mol N2与3 mol H2反应生成的NH3分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某化学反应A2(g)+2B2(g)═2AB2(g)(A2、B2、AB2的结构式分别为 A═A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2(g)+2B2(g)═2AB2(g)(A2、B2、AB2的结构式分别为 A═A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热或点燃条件 | |
| B. | 该反应若生成2molAB2(g)则放出的热量为 (E1-E2) kJ | |
| C. | 该反应断开化学键消耗的总能量大于形成化学键释放的总能量 | |
| D. | 生成2 mol B-A键放出E2 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ②⑤ | C. | ④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
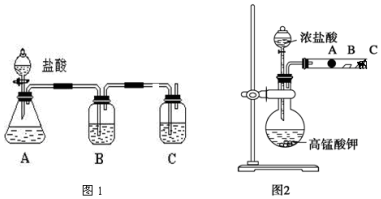
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
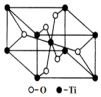 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SiF4和SO32-的中心原子均为sp2杂化 | |
| D. | SF6中有6对相同的成键电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲为铁锈 | B. | 乙为FeO | C. | 丙为NO2 | D. | 丁为CuCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com