
【题目】现有含NaCl、MgCl2和Na2SO4的混合溶液,某兴趣小组的同学欲提取纯净的NaCl晶体,设计了如下实验:
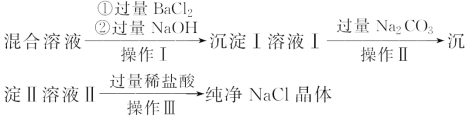
请回答下列问题:
(1)写出沉淀Ⅰ和沉淀Ⅱ所含物质的化学式。沉淀Ⅰ:_________、沉淀Ⅱ:_______。
(2)上述流程中,加入过量稀盐酸的目的是______________。
(3)操作Ⅲ中需使用的玻璃仪器是________________________。
【答案】Mg(OH)2、BaSO4 BaCO3 除去过量的NaOH和Na2CO3 玻璃棒、酒精灯
【解析】
(1)含NaCl、MgCl2和Na2SO4的混合溶液,加入过量的氯化钡、氢氧化钠,分别与SO42-、OH-反应生成BaSO4、Mg(OH)2沉淀;过滤后溶液中含有大量Ba2+、OH-、Na+、Cl-,加入过量Na2CO3,CO32-与Ba2+反应生成BaCO3沉淀;
(2)溶液Ⅱ含有的离子有OH-、Na+、Cl-、CO32-;
(3)提取纯净的NaCl晶体,操作Ⅲ为蒸发结晶,依据蒸发结晶实验选择合适的仪器。
(1)含NaCl、MgCl2和Na2SO4的混合溶液,加入过量的氯化钡、氢氧化钠,分别与SO42-、OH-反应生成BaSO4、Mg(OH)2沉淀,所以沉淀Ⅰ为BaSO4、Mg(OH)2沉淀混合物;过滤后溶液中含有大量的Ba2+、OH-、Na+、Cl-,加入过量Na2CO3,CO32-与Ba2+反应生成BaCO3沉淀,所以沉淀Ⅱ为BaCO3;
(2)溶液Ⅱ含有的离子有OH-、Na+、Cl-、CO32-,要得到纯净的NaCl,应加入盐酸调节溶液的pH=7,使CO32-转化为CO2气体,OH-转化为H2O。所以加入过量稀盐酸的目的是除去除去过量的NaOH和Na2CO3;
(3)从NaCl溶液中获得溶质NaCl,提取纯净的NaCl晶体,操作Ⅲ为蒸发结晶,用到的玻璃仪器有:酒精灯、玻璃棒。


科目:高中化学 来源: 题型:
【题目】标准状况下,分别将充满下列气体的容器倒扣于水槽中(设气体不发生扩散),充分反应后,瓶内溶液的物质的量浓度不等于![]() molL﹣1(约0.045molL﹣1)的是( )
molL﹣1(约0.045molL﹣1)的是( )
A.HClB.NO2、O2C.SO2、N2D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中都分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态:2X(?)+ Y(?)![]() a Z(g)。
a Z(g)。
此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断不正确的是
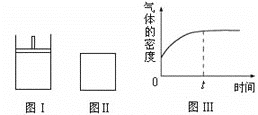
A. 物质Z的化学计量数a =1
B. 若X、Y均为气态,则在平衡时X的转化率:Ⅰ>Ⅱ
C. 若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
D. 若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A、C、E是常见的金属单质,E为紫红色,反应①可用于焊接铁轨,B是赤铁矿的主要成分,F的溶液中加入KSCN溶液变红。(部分反应物和生成物省略)
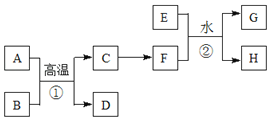
请回答下列问题:
(1)B的化学式是____________D的化学式是_____________
(2)可选用__________(填“字母”)实现反应C→F的转化。
a.稀盐酸 b.氯气/点燃 c.CuSO4溶液
(3)反应①的化学方程式为___________________________。
(4)反应②的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在质量分数为28%的KOH水溶液中,OH-与H2O数目之比是________。
(2)由硫酸钾、硫酸铁和硫酸组成的混合溶液,其中c(H+)=0.1 mol/L,c(Fe3+)=0.3 mol/L,c(SO42-)=0.6 mol/L,则c(K+)为________。
(3)相同物质的量浓度的氯化钠、氯化镁、氯化铝溶液,分别与硝酸银溶液反应,当生成沉淀的质量之比为3∶2∶1时,消耗三种盐溶液的体积比为________。
(4)某状况下a L氨气(此时气体摩尔体积为Vm)溶解在一定量的水中形成b mL氨水溶液,所得溶液的密度为ρ g/mL,则该氨水的物质的量浓度可表示为________ mol/L;氨水的质量分数为________。
(5)已知1.505×1023个X气体分子的质量是8 g,则X气体的摩尔质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应是化学实验现象的本质,根据描述回答下列问题:
(1)在BaCl2溶液中通入SO2气体,未见沉淀生成,若先通入或加入下列的另一种物质,再通入SO2能看到沉淀的有___(填序号)。
①NO2 ②NH3 ③HCl ④FeCl3溶液 ⑤CO2
(2)A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
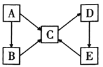
若A为金属单质,B、C均属于盐类,B溶液呈黄色,与硫氰化钾溶液混合后显红色,D是一种白色沉淀,E是一种不溶性碱。B溶液呈酸性的原因是___(用离子方程式表示);选用氢碘酸可与E反应实现E→C的转化,该反应的离子方程式为___。
(3)①通常条件下,未经碾磨的镁粉和未经擦拭的镁条跟冷水不反应,因为表面有一层保护膜。去除这层氧化膜后,镁与冷水就会发生明显的反应,看到有大量细腻的气泡产生。在室温条件下,反应生成的难溶于水的氢氧化镁,沉积在表面形成致密薄膜,几分钟后,反应很快停止。给反应混合液加热,镁跟水的作用又会重新进行,你觉得可能的原因是:___,此时滴加酚酞试液,___(填“会”或“不会”)出现溶液变红的现象。
②取一段擦去表层氧化膜的镁条,卷成螺旋状,插入盛满食盐水的试管中,将试管倒扣在盛有食盐水的烧杯中,可以迅速观察到镁持续不断地跟水反应,你觉得可能的原因是___。
③去除了氧化膜的金属Mg可以与NaHCO3溶液作用析出氢气,溶液中有白色难溶物生成。这是由于镁直接与水反应,转化为H2和Mg(OH)2。溶解在水中的少量Mg(OH)2电离生成的OH-与溶液中的HCO3-反应生成CO32-,促使反应生成的Mg(OH)2更多溶解。溶液中Mg2+、OH-、CO32-,结合析出白色难溶物Mg2(OH)2CO3。请根据以上信息写出Mg与NaHCO3溶液的总反应式:___(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,室温下分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2 和O2 的混合气体,若将H2、O2 的混合气体点燃引爆。活塞先左弹,恢复室温后,活塞右滑停留于容器的中央。则原来H2、O2 的物质的量之比可能为①4∶5 ② 2∶5 ③3∶8 ④7∶2
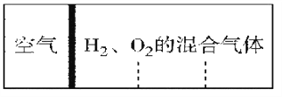
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁(26Fe)、钴(27Co)两种元素均为第四周期元素,它们的用途极为广泛。回答:
(1)26Fe位于元素周期表的第______纵行。
(2)为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究:
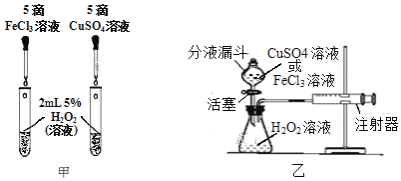
①如图甲,可通过观察______来定性比较两者的催化效果。
②如图乙,要定量比较两者的催化效果,可测量生成等体积气体所需的______。
③在FeCl3溶液中,究竟是哪种粒子起催化作用?
猜想1:铁离子(Fe3+)起催化作用;
猜想2:______起催化作用;猜想3:______起催化作用;……
若要验证猜想1成立,只需要在图甲的两只试管中分别加入同浓度、同体积的______和______,再通过观察现象,即可证明猜想1成立。
(3)请仔细阅读、分析下列有关利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程图,回答下列问题:
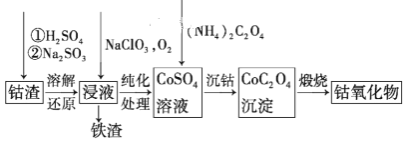
铁渣中铁元素的化合价为______,在空气中煅烧CoC2O4(草酸钴,其中碳为+3价),生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com