
【题目】下列反应中反应物总能量小于生成物总能量的是( )
A.钠和水的反应
B.炭与水蒸气制水煤气的反应
C.盐酸与氢氧化钠溶液的反应
D.铝在氧气中燃烧的反应
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,其原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下X、Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是___。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。该化合物溶液浓度为0.1 mol/L时, pH最接近_____。
A.5.6 B.7.0 C.8.4 D.13.0
(3)在一个装有可移动活塞的恒温容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g) ΔH<0,反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,此时总容积为1.0 L。
2CA3(g) ΔH<0,反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,此时总容积为1.0 L。
①达此平衡前各物质起始的量如下,其中不合理的是_______________;
A.C2 0.6mol, A2 0.5mol, CA3 0mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.55mol,A2 0.35mol,CA3 0.1mol
D.C2 0.8mol,A2 1.1mol,CA3 0mol
②此平衡体系的平衡常数K=____________________;
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将_________(填“正向”、“逆向”或“不”)移动。
(4)已知常温常压下,0.5mol B2A2与足量的D2反应,生成BD2和液态A2D,放出649.8 kJ 的热量。写出B2A2燃烧热的热化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中投入一定量反应物发生储氢反应:LaNi5(s)+3H2(g)![]() LaNi5H6(s) △H =-301kJ/moL。左某温度下,达到平衡状态,溅得氢气压强为2Mpa;若温度不变,缩小体积至原来的一半,重新达到平衡。下列说法不正确的是
LaNi5H6(s) △H =-301kJ/moL。左某温度下,达到平衡状态,溅得氢气压强为2Mpa;若温度不变,缩小体积至原来的一半,重新达到平衡。下列说法不正确的是
A. 重新达到新平衡时H2的压强仍然为2Mpa
B. 当LaNi5的浓度不再变化时,表明达到平衡状态
C. 扩大容器体积,重新达到平衡时n(H2)增多
D. 增大压强。降低温度,有利于储氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL的某稀H2SO4溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴入氨水体积变化如图.下列分析正确的是
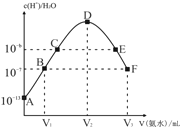
A. 稀硫酸的浓度为0.1mol/L
B. C点和E点溶液:pH=14-a
C. c(NH4+)/c(NH3·H2O);B点>F点
D. E溶液中存在c(NH4+)>c(SO42-)> c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i.CH3OH(g) ![]() CO(g)+2H2 △H =+90kJ·mol-1
CO(g)+2H2 △H =+90kJ·mol-1
ii.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
(1)向VL恒容密闭容器中充入lmolCH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T)变化关系的曲线为_______________(填“A”或“B”),理由为_____________。T1℃时,体系的平衡压强与起始压强之比为_________________________。

(2)起始向10L恒容密闭容器中充入lmolCH3OH(g)和1molH2O(g),发生反应i利反应ii,体系中CO的平衡体积分数与温度(T)和压强(p)的关系如图2所示。
①随着温度升高,n(CO2)/n(CO)的值______(填“增大““减小”或“不变”),理由为____________。
②p1、p2、p3由大到小的顺序为___________________。
③测得C点时、休系中CO2的物质的量为0.2mol,则T2℃时,反应ii的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及H2O、Cr2O72-、NO2-、H+、NO3-、Cr3+六种微粒,已知反应过程中NO3-浓度变化如图所示,且氧化剂和还原剂的物质的量之比为1∶3,下列判断错误的是( )
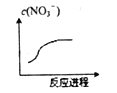
A. Cr2O72-中Cr化合价是+6 价 B. 反应的氧化产物是NO3-
C. 消耗1mol氧化剂,转移电子6mol D. 反应中Cr3+被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是__________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式为__________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有__________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是__________(填序号)。
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.1molClO2,则转移的电子数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。用含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
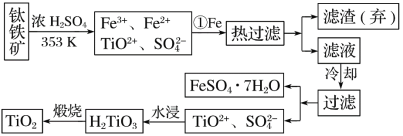
(1)步骤①加Fe的目的是________________________________________________________;步骤②冷却的目的是________________________________________________________。
(2)上述制备TiO2的过程中,可以利用的副产物是______________________。
(3)由金红石(TiO2)制取单质Ti,涉及到的步骤为TiO2―→TiCl4![]() Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com