
| A、常温常压下,14g N2含有的原子数目为0.5NA |
| B、1mol Na被完全氧化生成Na2O2,失去2NA个电子 |
| C、11.2L O2所含的分子数可能为0.5NA |
| D、0.1mol的Na2O2中含阴离子数是0.2NA |
| m |
| M |
| 14g |
| 14g/mol |


科目:高中化学 来源: 题型:
| A、取代,4 mol Cl2 |
| B、加成,2mol Cl2 |
| C、加成,取代,3 mol Cl2 |
| D、加成,消去,取代,3 mol Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
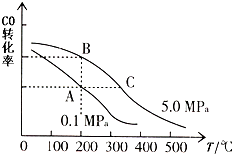 (1)在电化学中,常用碳作电极:
(1)在电化学中,常用碳作电极:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500 mL 1 mol/L的KNO3溶液 |
| B、500 mL 1 mol/L的Ba(NO3)2溶液 |
| C、100 mL 0.5 mol/L的Mg(NO3)2溶液 |
| D、1 L 0.5 mol/L的Fe(NO3)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、酸性高锰酸钾与少量双氧水反应:2MnO
| ||||
B、用石墨电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
C、Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++HCO
| ||||
| D、向NaClO溶液中通入过量CO2;CO2+ClO-+H2O=HCO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第三周期零族元素 |
| B、第四周期ⅡB族 |
| C、第四周期Ⅷ族 |
| D、第四周期ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
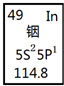
| A、铟元素的质量数是114.8 |
| B、铟元素的相对原子质量是115,中子数为66 |
| C、铟元素是一种主族元素,位于第五周期第ⅢA族 |
| D、铟原子最外层有3个能量相同的电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com