
����Ŀ�����Ļ����������������й㷺���ڣ�
��1�����Ȱ���NH2Cl���ĵ���ʽΪ �� ��ͨ����ӦNH3��g��+Cl2��g��=NH2Cl��g��+HCl��g���Ʊ��Ȱ�����֪���ֻ�ѧ���ļ������±���ʾ���ٶ���ͬ������ͬ�ֻ�ѧ���ļ���һ��������������Ӧ�ġ�H= ��
��ѧ�� | ����/��kJmol��1�� |
N��H | 391.3 |
Cl��Cl | 243.0 |
N��Cl | 191.2 |
H��Cl | 431.8 |
��NH2Cl��ˮ��Ӧ����ǿ�����Ե����ʣ�������Ч�������������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2���ý�̿��ԭNO�ķ�ӦΪ��2NO��g��+C��s��N2��g��+CO2��g�������ݻ���Ϊ1L�ļס��ҡ����������ݺ��£���Ӧ�¶ȷֱ�Ϊ400�桢400�桢T�棩�����зֱ���������Ľ�̿��һ������NO����ø�������n��NO���淴Ӧʱ��t�ı仯������±���ʾ��
t/min | 0 | 40 | 80 | 120 | 160 |
n��NO������������/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n��NO������������/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n��NO������������/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�ٸ÷�ӦΪ������ȡ������ȡ�����Ӧ��
����������200min�ﵽƽ��״̬����0��200min����NO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v��NO��= ��
��3���ý�̿��ԭNO2�ķ�ӦΪ��2NO2��g��+2C��s��N2��g��+2CO2��g�����ں��������£�1mol NO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ�� 
�� A��B�����Ũ��ƽ�ⳣ����ϵ��Kc��A��Kc��B���������������=������
��A��B��C������NO2��ת������ߵ������A����B����C�����㣮
�ۼ���C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp��C��=��Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
���𰸡�
��1�� ��+11.3kJ?mol��1��NH2Cl+H2O?NH3+HClO
��+11.3kJ?mol��1��NH2Cl+H2O?NH3+HClO
��2�����ȣ�0.003mol?L��1?min��1
��3��=��A��2MPa
���������⣺��1�����Ȱ��ɿ����ǰ���������һ����ԭ�ӱ���ԭ��ȡ���Ľṹ�����Ȱ��ĵ���ʽΪ��  ��NH3��g��+Cl2��g��=NH2Cl��g��+HCl��g������H=��Ӧ��ļ���֮�ͩ�������ļ���֮��=��3��391.3+243.0������2��391.3+191.2+431.8��=+11.3 kJmol��1�� ���Դ��ǣ�
��NH3��g��+Cl2��g��=NH2Cl��g��+HCl��g������H=��Ӧ��ļ���֮�ͩ�������ļ���֮��=��3��391.3+243.0������2��391.3+191.2+431.8��=+11.3 kJmol��1�� ���Դ��ǣ�  ��+11.3 kJmol��1��
��+11.3 kJmol��1��
��NH2Cl��ˮ��Ӧ����ǿ�����Ե����ʣ�������Ч�������������÷�Ӧ�Ļ�ѧ����ʽΪNH2Cl+H2ONH3+HClO��
���Դ��ǣ�NH2Cl+H2ONH3+HClO��
����2���ٱ������������Ͷ������ͬ���ﵽƽ������ʱ��϶̣�˵���������¶Ƚϸߣ�������ƽ��ʱNO��Ũ�ȱȼ������ߣ�˵���¶����ߺ������淽���ƶ������淽��Ϊ���ȷ��÷�Ӧ�Ǹ����ȷ�Ӧ��
���Դ��ǣ����ȣ�
�ڸ���2NO��g��+C��s��N2��g��+CO2��g����ǰ������������䣬��ͬ�¶��£�������Ϊ��Чƽ�⣬����ƽ��ʱNO�����ʵ���Ϊ��ƽ��ʱ��һ�룬Ϊ0.4mol����0��200min����NO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v��NO��= ![]() =0.003 molL��1min��1��
=0.003 molL��1min��1��
���Դ��ǣ�0.003 molL��1min��1��
����3����A��B������¶���ͬ��ƽ�ⳣ��Kֻ���¶��йأ���Ũ��ƽ�ⳣ����ϵ��Kc��A��=Kc��B����
���Դ��ǣ�=���ڷ�Ӧ2NO2��g��+2C��s��N2��g��+2CO2��g���Ǹ������������ķ�Ӧ������ѹǿƽ�������ƶ�����A��B��C������NO2��ת������ߵ���A�㣻
���Դ��ǣ�A����1mol NO2������C�����÷�Ӧ���跴Ӧ��������x��������ʽ��
2NO2��g��+ | 2C��s�� | N2��g��+ | 2CO2��g�� | ||
nʼ�� | 1 | 0 | 0 | ||
nת�� | x | 0.5x | x | ||
nƽ�� | 1��x | 0.5x | x |
��ͼ֪C��ʱNO2��CO2�����ʵ���Ũ�ȣ���1��x=x�����x=0.5����ƽ��ʱ�ܵ����ʵ���Ϊ1.25mol��C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp��C��=  =2MPa��
=2MPa��
���Դ��ǣ�2 MPa��
�����㾫����������Ĺؼ��������⻯ѧƽ��ļ�������֪ʶ�����շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������м������ӷ�Ӧ��
�� Cr2O![]() ��14H����6Cl��===2Cr3����3Cl2����7H2O
��14H����6Cl��===2Cr3����3Cl2����7H2O
�� 2Fe2����Br2===2Fe3����2Br�� �� 2Br����Cl2=== Br2��2Cl��
�� 2Fe3����SO2��2H2O===2Fe2����SO![]() ��4H��
��4H��
�����й����ʵıȽ�����ȷ����(�� ��)��
A. ��������Cr2O![]() >Cl2>Fe3�� B. ��������Cl2>Br2>Cr2O
>Cl2>Fe3�� B. ��������Cl2>Br2>Cr2O![]()
C. ��ԭ����SO2<Fe2��<Br�� D. ��ԭ����Cl��>Cr3��>Fe2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1000mlij��ɫ����Һ�г�����0.2molL��1��Na+�⣬�����ܺ������������е�һ�ֻ���֣�
������ | K+��NH4+��Fe3+��Ba2+ |
������ | Cl����CO32����HCO3����SO42�� |
�ֽ�������ʵ������������Լ���������������֪��NH4++OH����Ũ��=NH3��+H2O��
��1��ԭ��Һ�п϶����ڵ������ǣ���Na+�� �� �϶������ڵ������� ��
��2��д�����ɰ�ɫ����B�����ӷ���ʽ�� �� д������A����ϡ��������ӷ���ʽ�� ��
��3������ҺA�ͳ���A�ֿ��IJ����ǹ��ˣ�ϴ�ӣ�ϴ�ӵIJ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ��������۵�674�桢�е�1023�棻���Ȼ�����300��������������������ˮ������ǿ�ҵ���ˮ�ԣ���500���������Ȼ��������������ܷ������ַ�Ӧ����Ӧ֮һΪ��12FeCl2+3O2 ![]() 2Fe2O3+8FeCl3 �� ij�о�С��ѡ������װ�ã��г�װ��ʡ�ԣ�װ�ÿ��ظ�ѡ�ã����з�Ӧ��̽�����ش��������⣺
2Fe2O3+8FeCl3 �� ij�о�С��ѡ������װ�ã��г�װ��ʡ�ԣ�װ�ÿ��ظ�ѡ�ã����з�Ӧ��̽�����ش��������⣺ 
��1��װ�õĺ�������˳��ΪA����D������Eװ��U�ι�������Ϊ�ֵ��ܵ�Ŀ���� ��
��2��Aװ���з�����Ӧ�Ļ�ѧ����ʽΪ ��
��3����Ӧ���̷��֣�װ��B�г����ɺ���ɫ�����⣬���۲쵽����ɫ���壬���ɸ�����Ļ�ѧ����ʽΪ ��
��4����B�г�ַ�Ӧ��ֹͣ���Ⱥ������ͨ������ ��
��5�����ʵ�飺 ������Eװ��U�ι���Ĺ�����֤Fe��OH��3����� ��
�ڲⶨװ��B�IJ�����������Ԫ�ص����������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.ij�л���ȼ��ֻ����CO2��H2O���Ҷ������ʵ�����ȣ�����л�������ΪCnH2n
B.һ������������������ȼ�ղ�ͨ����ʯ�ң����ٵ������������ˮ���������
C.ij��̬��CxHy������O2ǡ����ȫ��Ӧ�������Ӧǰ������������䣨�¶ȣ�100�棩����y=4����������٣���y��4������y��4
D.��ͬ������������ȫȼ�գ����ĵ�O2Խ�࣬��������Ԫ�صİٷֺ���Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦNa2CO3+2HCl=2NaCl+H2O + CO2�������ӷ���ʽ��
A. CO32-+2H+ = H2O+CO2��B. CO32-+H+=H2O+CO2��
C. CO32-+2HCl=2Cl-+H2O+CO2��D. Na2CO3+2H+=2Na++H2O+CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ϢϢ��أ�����˵����ȷ���ǣ� ��
A.ҽ�þƾ���Ũ��ͨ����95%
B.���ۡ���֬�͵����ʶ��Ǹ߷��ӻ�����
C.���г��ּ�����ͨ���ǵ绯ѧ��ʴ����
D.úȼ�ղ���������ֱ���ŷŵ������У������ˮ��ĸ�Ӫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ơ���װ��ʹ�÷�������ѧ��ѧʵ��Ļ�������ͼΪ����ʵ��װ�á�
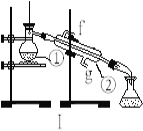
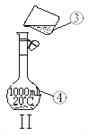
��1��д���������������ƣ���__________����_________ ��
��2��������װ��I��ȡ����ˮ���������������������ʵ�飬��ȴˮ��____________�ڽ�������g��f��
��3����������250 mL 0.2 mol��L��1 NaCl��Һ������װ��II��ijͬѧ���ƴ���Һʱת�Ʋ�����ʾ��ͼ��ͼ������������һ����δ�ò�������������һ����_________________ ��
��4�������ƹ����У���������������ȷ�ģ���������������Ƶ�NaCl��Һ��Ũ��ƫ����______��
A.û��ϴ���ձ��Ͳ����� B.����ƿ�����������������ˮ C.����ʱ���ӿ̶��� D.���ݺ�����ƿ������ҡ�ȣ����ú�Һ����ڿ̶��ߣ��ټ�ˮ���̶��ߡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����Ҫ��д�����з�Ӧ�Ļ�ѧ����ʽ��
���ɱ���FeCl3��Һ�Ʊ�Fe(OH)3����_______________________________��
������ḯʴ����____________________________________��
��2����Ҫ��д�����з�Ӧ�����ӷ���ʽ��
����Ư������Ч�ɷ�Ϊ���������____________________________________��
�������軯����Һ������Һ�к���Fe3+____________________________________��
����NaHSO4��Һ����μ���Ba(OH)2��Һ������____________________________________��������������Һ�м����μ�Ba(OH)2��Һ��д���˲������ӷ���ʽ_______________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com