
【题目】有A、B、C、D、E五种短周期元素,其原子序数依次增大,在周期表中A的原子半径最小,B的主族序数是周期序数的2倍,D是地壳中含量最多的元素,在周期表中A和E同主族,回答下列问题:
(1)化合物BD2的电子式是_______。
(2)化合物CA3的结构式为______。
(3)C的最低价氢化物与C的最高价氧化物的水化物反应生成盐的化学式为____。
(4)用电子式表示化合物A2D的形成过程:____________。
(5)将物质的量比为1:1的CO2和H2O组成的混合气通入到a mol的过量固体E2D2中,将反应后的固体混合物加入到500mL1mol·L-1盐酸中,则产生无色混合气体的体积在标准状况下为bL,反应后溶液呈中性,则a=____,b=___。
【答案】![]()
 NH4NO3
NH4NO3 ![]() 0.25 2.8
0.25 2.8
【解析】
A为元素周期表中原子半径最小的元素,则A为H元素;D是地壳中含量最多的元素,则D是O元素;A、B、C、D、E五种短周期元素原子序数依次增大,B的主族序数是周期序数的2倍,则B是C元素、C是N元素;A和E同主族,则E是Na元素。
(1)化合物BD2为CO2,CO2为共价化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
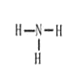
(2)化合物CA3为NH3,NH3的空间构型为三角锥形,结构式为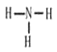 ,故答案为:
,故答案为: ;
;
(3)C是N元素,N元素的最低价氢化物为NH3,最高价氧化物的水化物为HNO3,NH3与HNO3反应生成NH4NO3,故答案为:NH4NO3;
(4)A2D为H2O,用电子式表示H2O的形成过程为![]() ,故答案为:
,故答案为:![]() ;
;
(5)E2D2为Na2O2,由题意可知,CO2和H2O组成的混合气与过量Na2O2反应得到的碳酸钠、氢氧化钠和过氧化钠的固体混合物,加入到500mL1mol·L-1盐酸中,碳酸氢钠、过氧化钠与盐酸反应生成标准状况下bL二氧化碳和氧气的无色混合气体,反应后溶液呈中性说明盐酸与固体混合物恰好完全反应得到氯化钠溶液,由电荷守恒和钠原子个数守恒可知,2n(Na2O2)=n(NaCl)=n(HCl)=0.5mol,则a=0.25mol;设CO2和H2O均为xmol,xmolCO2与xmol Na2O2反应生成xmol Na2CO3,xmolH2O与xmol Na2O2反应生成2xmol NaOH,xmolNa2CO3与盐酸反应生成xmol CO2,(a—2x)mol Na2O2与盐酸反应生成![]() molO2,则b=[xmol+
molO2,则b=[xmol+![]() ]mol×22.4L/mol=11.2aL=2.8L,故答案为:0.25;2.8。
]mol×22.4L/mol=11.2aL=2.8L,故答案为:0.25;2.8。


科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )

A. Y 的电极反应: Pb-2e- = Pb2+
B. 铅蓄电池工作时SO42-向 Y 极移动
C. 电解池的反应仅有2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D. 每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。
(1)T℃时,WO3 经如下的四步反应生成 W。每一步反应的焓变和平衡常数如下:
WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+2H2(g)![]() W(s)+2H2O(g) △H4 K4
W(s)+2H2O(g) △H4 K4
则该温度下,WO3(s)+3H2(g)![]() W(s)+3H2O(g) K=_____。
W(s)+3H2O(g) K=_____。
(2)T1℃时,将 4molH2 和足量 WO3 置于 2 L 密闭容器中,发生反应:O3(s)+3H2(g)![]() W(s)+3H2O(g)
W(s)+3H2O(g)
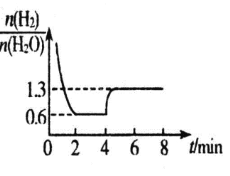
混合气体各组分物质的量之比随时间变化的关系如图所示:
①下列选项中能说明反应已经达到平衡的是_____。(填字母)
a.反应速率ν(H2)=ν(H2O)
b.每断裂 3molH-H 键的同时断裂 3molO-H 键
c.反应热不变
d.混合气体的密度不再改变 e.体系的压强不再改变
②反应在 2min 时达到平衡,此时 H2 的平衡转化率 a=_____%。
③若在 4 min 时升高并维持温度为 T2℃,变化如图所示,则该反应的△H_____0,若在 8min 时缩小 容器容积,则n(H2)/n(H2O)________1.3。(填“>”“ <”或“=”)
(3)利用电解法可以从合金碳化钨(WC)废料中回收钨元素(合金中钨、碳均为单质)。电解时,用合 金碳化钨做阳极,不锈钢做阴极,盐酸溶液为电解液,阳极析出钨酸(H2WO4)并放出 CO2。该阳极的电 极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 标准状况下,2.24L 四氯化碳含有的分子数目为 0.1NA
B. 25℃时,0.1 mol·L-1Na2S溶液中含有Na+的数目为0.2NA
C. 64g的SO2与足量的O2充分反应后可得到NA个SO3分子
D. 2.3gNa与O2完全反应生成3.6g产物时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。
H2(g)+I2(g)。
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=3mol·L-1,则此温度下反应①的平衡常数为
A. 9 mol2·L-2B. 12 mol2·L-2C. 16 mol2·L-2D. 20 mol2·L-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的2 L的密闭容器中,加入3 mol A和1 mol B,发生如下反应:3A(g)+B(g)![]() 2C(g)+3D(s),5 min达到平衡时,n(B):n(C) =1:3。
2C(g)+3D(s),5 min达到平衡时,n(B):n(C) =1:3。
(1)0~5 min内用B表示的平均反应速率为_______;达到平衡时,A的转化率为_______。
(2)达到平衡时容器内气体压强与反应前容器内气体压强之比_________。
(3)维持容器的温度不变,若缩小容器的体积,则平衡将向_____(填“正向移动”“逆向移动”或“不移动”)。
(4)达到平衡后,若保持温度不变,将C从容器中分离出一部分,则化学平衡常数____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验探究同主族碳、硅两元素的非金属性的强弱,根据要求完成下列问题:
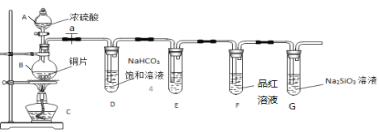
(1)填写所示仪器名称:A _______,B ______。
(2)铜与浓硫酸反应的化学方程式是____________________。
(3)装置E中足量酸性KMnO4溶液的作用是_________________。
(4)能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________。
(5)依据试管D中实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填“能”或“否”),试管D中发生反应的离子方程式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com