
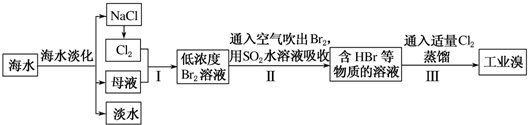
分析 通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2.
(1)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(2)SO2吸收溴,依据氧化还原反应生成物书写基本规律,Br元素在自然中-1价稳定.由于此反应有强酸HBr和H2SO4生成,易腐蚀设备,据此写出工业生产需要解决的问题;
(3)工业制溴中提纯溴的方法,主要是利用蒸馏方法,由于Br2具有强氧化性,易把橡胶塞和橡胶管氧化腐蚀,所以不用橡胶塞和橡胶管;由于题干中给出信息Br2的沸点是59℃,提纯溴必须收集59℃时的馏分,所以控制温度得到馏分是关键;C中液体为冷凝下来的纯溴,则颜色为深棕红色,除去该产物中仍残留的少量Cl2,加入NaBr溶液,和氯气反应生成氯化钠和溴单质,达到除去氯气的目的,充分反应后,用蒸馏的方法得到.
解答 解:通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2.
(1)海水中溴元素含量较少,步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素,
故答案为:富集溴元素;
(2)在水溶液里溴和二氧化硫反应离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,由此反应可知,生成物为强酸,所以除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀,
故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-;强酸对设备的严重腐蚀;
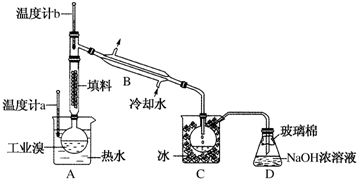
(3)①图中仪器B的名称是冷凝管,故答案为:冷凝管;
②溴能腐蚀橡胶,所以整套实验装置中仪器连接均不能用橡胶塞和橡胶管,故答案为:溴腐蚀橡胶;
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:控制温度计b的温度,并收集59℃的馏分,温度过高或过低都不利于溴的收集,
故答案为:控制温度计b的温度,并收集59℃的馏分;
④C中液体产物为溴,颜色为深红棕色,为除去该产物中仍残留的少量C12,可向其中加入NaBr溶液,充分反应后,再进行分离的操作是分液,
故答案为:深红棕色;分液.
点评 本题考查了海水资源的综合利用,从整体上把握溴的提纯过程,知道提纯过程中发生的反应及基本操作方法,再结合物质的性质分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 4g氢氧化钠溶于水,电离出的离子总数为2NA | |
| B. | 35.5g氯气中所含的原子数为2NA | |
| C. | 0.1mol钠变成钠离子时,失去的电子数目0.1NA | |
| D. | 实验室制氯气,得到2.24L(标准状况下)氯气时电子转移数0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ②④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水蒸发制海盐的过程中只发生了物理变化 | |
| B. | 加入明矾,使海水的盐分沉淀并淡化 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析法等 | |
| D. | 大海中含有钾、溴、碘等元素,需经过氧化还原反应才可得到钾、溴、碘的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
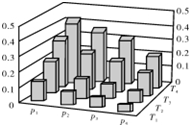
| A. | P1>P2>P3>P4 | |
| B. | 甲醇的物质的量分数越高,反应的平衡常数越大 | |
| C. | 若T1>T2>T3>T4,则该反应为放热反应 | |
| D. | 缩小容积,可以提高CH3OH在混合物中的质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用右图装置测定中和热的实验步骤如下:
利用右图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温 度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1体积NO | B. | 1体积NO2和$\frac{1}{2}$体积O2 | ||
| C. | $\frac{1}{4}$体积O2 | D. | $\frac{1}{3}$体积NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com