
【题目】在密闭容器中,使1 mol N2和3 mol H2混合发生下列反应:N2 (g) + 3H2 (g)![]() 2NH3 (g) ΔH <0。
2NH3 (g) ΔH <0。
(1)达到平衡时, 充入N2并保持体积不变,平衡将______移动(填“正向”、“逆向”或“不”)。
(2)达到平衡时,充入氩气(Ar)并保持体积不变,平衡将______移动(同上)。
(3)达到平衡时,充入氩气(Ar),并保持压强不变,平衡将______移动(同上)。
(4)达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡______移动(同上)。
(5)保持体积不变,升高温度时,混和气体的平均相对分子质量______,密度_______(填“变大”、“变小”或“不变”)。
(6)当反应达到平衡时,N2和H2的浓度比是______;N2和H2的转化率比是______。
【答案】 正向 不 逆向 正向 变小 不变 1:3 1:3
【解析】(1). 达到平衡时, 充入N2并保持体积不变,则c(N2)增大,平衡将正向移动,故答案是:正向。
(2). 达到平衡时,充入氩气(Ar)并保持体积不变,总压增大,分压不变,则平衡不移动,故答案是:不。
(3). 达到平衡时,充入氩气(Ar),并保持压强不变,平衡将逆向移动,故答案为:逆向。
(4). 达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,相当于增大压强,则平衡正向移动,故答案是:正向。
(5).因该反应是放热反应,所以保持体积不变,升高温度时,平衡将逆向移动,混合气体的总物质的量增加,但总质量不变,根据M= ![]() 可知,混合气体的平均相对分子质量将变小;因容器体积不变,混合气体的总质量也不变,根据ρ=
可知,混合气体的平均相对分子质量将变小;因容器体积不变,混合气体的总质量也不变,根据ρ= ![]() 可知,混合气体的密度不变,故答案是:变小;不变。
可知,混合气体的密度不变,故答案是:变小;不变。
(6).设反应中N2消耗xmol,容器的体积是1L,根据三段式法,有:
N2 (g) + 3H2 (g)![]() 2NH3 (g)
2NH3 (g)
起始量(mol/L) 1 3 0
转化量(mol/L) x 3x 2x
平衡量(mol/L) 1-x 3-3x 2x
所以平衡时N2和H2的浓度比是![]() = 1:3,N2和H2的转化率比是
= 1:3,N2和H2的转化率比是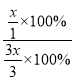 = 1:3,故答案是:1:3;1:3。
= 1:3,故答案是:1:3;1:3。


科目:高中化学 来源: 题型:
【题目】化学反应中,反应物用量、浓度或反应条件不同可能对生成物产生影响.下列反应的生成物不受上述因素影响的是()
A.铜与硝酸反应B.钠与氧气反应C.氢气与氯气反应D.氯化铝与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种短周期元素,A与B可形成BA型化合物,A元素的单质常用于自来水消毒;金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8;C元素有3种同位素C1、C2、C3 , 自然界里含量最多的是C1 , C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍;D的气态氢化物的水溶液呈碱性,而其最高价氧化物对应的水化物为强酸;E元素原子的最外层电子数比次外层电子数多4.
(1)写出下列元素的元素名称:A , B .
(2)写出C1、C3两种原子的符号:C1 , C3 .
(3)A、B、E形成的一种化合物是某种家用消毒液的有效成分,其电子式是 .
(4)D的最高价氧化物的水化物与其氢化物反应形成化合物的化学式是 , 其所含化学键的类型是 . 由最常见的E原子与C2原子形成的最简单分子0.5mol中,所含中子的数目是 .
(5)C、E的单质在碱性(KOH溶液)条件下可设计成一种燃料电池,其电极反应式为(负极)(正极) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO4在水溶液中能够完全电离出H+、Na+、和SO42- 。下列对于NaHSO4的分类中不正确的是
A.NaHSO4是盐 B.NaHSO4是酸式盐
C.NaHSO4是钠盐 D.NaHSO4是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色粉末晶体,常用作催化剂和陶瓷着色剂,300℃以上时分解生成3种氧化物。为确定其组成,某同学在实验室中进行了有关的实验探究。回答下列问题:
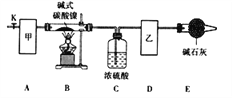
(l)甲、乙两装置可分别选取下列装置______、_______(填字母,装置可重复选取)。

(2)称取一定量的碱式碳酸镍样品,放入硬质玻璃管内;安装好实验仪器,检查装置气密性;加热硬质玻璃管,当装置C中________________(填实验现象)时,停止加热;打开活塞K,缓缓通入空气,其目的是______________________________。
(3)装置A的作用是________________________________________________,若没有装置E,则会使x/z__________(填写“偏大”或“偏小”或“无影响”)。
(4)实验前后测得下表所示数据:
装置B中样品质量/g | 装置C 质量/g | 装置D质量/g | |
实验前 | 3.77 | 132.00 | 41.00 |
实验后 | 2.25 | 133.08 | 41.44 |
已知碱式碳酸镍中Ni化合价为+2价,则该碱式碳酸镍分解的化学方程式为_______。
(5)采取上述实验装置进行该实验时,必须小心操作,且保证装置气密性良好,否则浓硫酸倒吸,可导致加热的硬质玻璃管炸裂。为防止浓硫酸倒吸入硬质玻璃管中,提出你的改进措施:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)( )
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-=== Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com