
| 257.7KJ |
| 0.4 |
| 16g |
| 32g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑥ |
| C、①③⑥ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
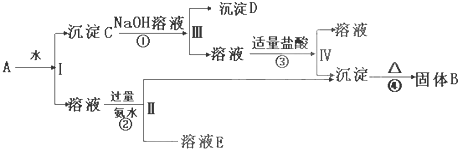
查看答案和解析>>
科目:高中化学 来源: 题型:
 ③白磷 ④氯气⑤
③白磷 ④氯气⑤ ⑥
⑥37 17 |
35 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓H2SO4 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其他条件不变时,升高温度,化学反应速率加快 |
| B、其他条件不变时,增大反应物的浓度,化学反应速率加快 |
| C、化学反应达到一定限度即“平衡状态”时,正反应的速率与逆反应的速率相等 |
| D、化学反应达到一定限度即“平衡状态”时,反应物的浓度与生成物的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水玻璃中通入二氧化碳:Na2SiO3+CO2+H2O=H2SiO3+CO32-+2Na+ |
| B、向氯化亚铁溶液中通入少量氯气:Fe2++Cl2=Fe3++2Cl- |
| C、硫酸厂的废气SO2用强碱溶液吸收:SO2+2OH-═SO42-+H2O |
| D、SiO2溶于NaOH溶液:SiO2+2OH-=SiO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com