
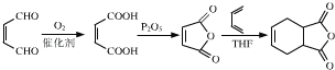
【题目】以下是以植物细胞中半纤维素木聚糖为原料合成镇痛药品莫沙朵林(G)的路线:

已知:①四氢呋喃结构式为 ![]() ,在流程中作反应的催化剂;
,在流程中作反应的催化剂;
②双烯合成反应: ;
;
③ .
.
回答下列问题:
(1)B的化学式__;B中官能团的名称_____;
(2)E→G的反应类型______
(3)C与新制氢氧化铜的悬浊液反应的化学方程式为________
(4)D和F的结构简式分别是______、________
(5)写出同时满足下列条件的E的一种同分异构体的简式________
①分子中含有苯环 ②能发生银镜反应 ③能与FeCl3溶液发生显色反应
(6)有机物H(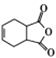 )是合成抗病毒药物阿昔洛韦的中间体.参照上述合成路线,写出以1,3﹣丁二烯为原料制备H的合成路线流程图(无机试剂任用): ________
)是合成抗病毒药物阿昔洛韦的中间体.参照上述合成路线,写出以1,3﹣丁二烯为原料制备H的合成路线流程图(无机试剂任用): ________
【答案】 C5H10O5 醛基、羟基 取代反应 ![]()
![]() CH3NHCOOH
CH3NHCOOH 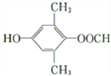
【解析】考查有机物的推断和合成,(1)根据B的结构简式,B的分子式为C5H10O5,含有的官能团是羟基和醛基;(2)根据G的结构简式,推出化合物F的结构简式为CH3NHCOOH,即E生成G的反应类型为酯化反应或取代反应;(3)C中含有醛基,与新制氢氧化铜悬浊液发生氧化反应,即化学方程式为![]() ;(4)根据E的结构简式,生成E的反应类型为加成反应,即D的结构简式为
;(4)根据E的结构简式,生成E的反应类型为加成反应,即D的结构简式为![]() ;F的结构简式为CH3NHCOOH;(5)含有苯环,能发生银镜反应,说明含有醛基,能与氯化铁发生显色反应,说明含有酚羟基,因此符合条件的同分异构体有
;F的结构简式为CH3NHCOOH;(5)含有苯环,能发生银镜反应,说明含有醛基,能与氯化铁发生显色反应,说明含有酚羟基,因此符合条件的同分异构体有 等;(6)根据信息③和上述合成路线,得出合成H的路线为
等;(6)根据信息③和上述合成路线,得出合成H的路线为
 。
。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.锌片与稀硫酸反应
B.Ba(OH)2·8H2O与NH4Cl反应
C.灼热的炭与CO2反应
D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL 0.2mol/L草酸溶液中逐滴加入等浓度的NaOH溶液,溶液中各微粒的物质的量与混合溶液pH的关系如图所示,下列说法正确的是
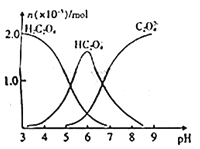
A. 当V(NaOH溶液)<10mL时,溶液中可能存在:c(Na+)=2c(C2O42-)+c(HC2O4-)
B. 当V(NaOH溶液)=10mL时,溶液中水的电离程度比纯水大
C. 当V(NaOH溶液)=15mL时,溶液中存在: c(Na+)>c(HC2O4-)>c(C2O42-)
D. 当V(NaOH溶液)=20mL时,溶液中存在:c(OH-)=2c(H2C2O4)+c(H+)+c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11.2L HF 中含有氟原子的数目为0.5 NA
B. 2 mol SO2 和1mol O2 混合充分反应后,转移电子的数目为4 NA
C. 46g NO2 和N2O4的混合物中含有氧原子的数目为2 NA
D. 1mol 乙醇分子中含有极性键的数目为8 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源。下图是从海水中提取某些原料的流程图。
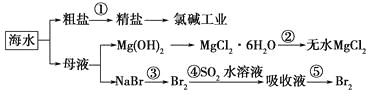
下列有关说法正确的是( )。
A. 第①步中除去粗盐中的SO42—、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸
B. 工业上通过氯碱工业制取金属钠
C. 从第③步到第⑤步的目的是浓缩、富集溴单质
D. 第②步的反应条件是高温加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. MnO2与浓盐酸混合加热:MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 大理石与盐酸反应:CO32﹣+2H+ = H2O+CO2↑
C. 向醋酸溶液中滴加NaOH溶液:OH-+H+![]() H2O
H2O
D. 漂白粉溶液吸收二氧化碳:Ca2++ CO2+ H2O = CaCO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH )是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为_____,其核外电子共占据_____个能级。
②甲醇和甲醛中碳原子的杂化方式分别为_____,其组成元素的电负性由小到大的顺序为________.
(2)在一定条件下,甲醇(沸点64.7℃)可转化为乙酸甲酯(CH3COOCH3,佛点57.1℃)
①乙酸甲酯分子中心键和节键的个数之比为_________;
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为______________。
(3)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T一碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被- 一个由四个碳原子组成的正四面体结构单元取代,如图所示。
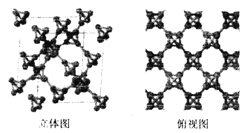
①T-碳与金刚石互称为_________;一个T-碳晶胞中含有______个碳原子。
②T-碳的密度非常小,约为金刚石的一半。试计算T-碳晶胞的边长和金刚石品胞的边长之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
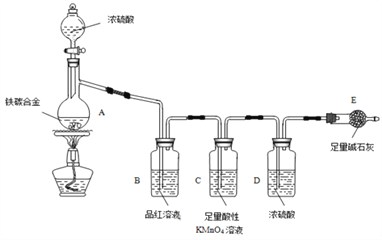
【题目】现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题(由实验装置引起的实验误差忽略不计)。
I、探究浓硫酸的某些性质
(1)按图示连接装置,检查装置___________,称量E的质量。
(2)将aɡ铁碳合金样品放入A中,再加入适量的浓硫酸,仪器A的名称为______,未点燃酒精灯前,A、B 均无明显现象,其原因是______________________。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象,如A中![]() ,写出A中C和浓硫酸发生反应的化学方程式:__________________________,B中的现象是_________________,因此可得到浓硫酸具有_____________性。
,写出A中C和浓硫酸发生反应的化学方程式:__________________________,B中的现象是_________________,因此可得到浓硫酸具有_____________性。
(4)随着反应的进行,浓硫酸浓度逐渐减小变为稀硫酸,A中还可能发生某些离子反应,写出相应的离子方程式:_________________、____________________。
II、测定铁的质量分数
(5)待A中固体完全消失并不再逸出气体时,停止加热,拆下E并称重,E增重bg。铁碳合金中铁的质量分数为___________________(写表达式)。
(6)某同学认为上述方法较复杂,使用如图所示的装置和其他常用的实验仪器测定某些数据即可。为了快速和准确地计算出铁的质量分数,最简便的实验操作是___________(填写代号)。

①用排水法测定H2的体积
②反应结束后,过滤、洗涤、干燥、称量残渣的质量
③ 测定反应前后装置和药品的总质量ag
【答案】气密性 蒸馏烧瓶 常温下,铁被浓硫酸钝化 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 品红溶液逐渐褪色 强氧化 2Fe3++Fe=3Fe2+ Fe+2H+=Fe2++H2↑
CO2↑+2SO2↑+2H2O 品红溶液逐渐褪色 强氧化 2Fe3++Fe=3Fe2+ Fe+2H+=Fe2++H2↑ ![]()
③
【解析】
(1)按图示连接好装置以后,首先检查装置的气密性:(2)根据仪器构造可知仪器A的名称为蒸馏烧瓶;常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应,故无明显现象;(3)浓硫酸具有强氧化性,在加热的条件下碳与浓硫酸反应的方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;二氧化硫具有漂白性,因此B中的现象是品红溶液逐渐褪色,根据以上分析可知浓硫酸具有强氧化性;(4)硫酸浓度减小后,稀硫酸与铁发生置换反应生成硫酸亚铁和氢气,另外铁还能与硫酸铁反应生成硫酸亚铁,离子方程式分别为Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+;(5)称取ag铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则ag铁碳合金中含碳元素的质量为
CO2↑+2SO2↑+2H2O;二氧化硫具有漂白性,因此B中的现象是品红溶液逐渐褪色,根据以上分析可知浓硫酸具有强氧化性;(4)硫酸浓度减小后,稀硫酸与铁发生置换反应生成硫酸亚铁和氢气,另外铁还能与硫酸铁反应生成硫酸亚铁,离子方程式分别为Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+;(5)称取ag铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则ag铁碳合金中含碳元素的质量为![]() ,则含铁的质量为
,则含铁的质量为![]() ,铁的质量分数为
,铁的质量分数为![]() ;(6)因为铁炭合金中的铁可以与稀硫酸反应生成氢气,瓶总质量的减少量即为氢气的生成量,而铁的质量可以通过氢气的质量求出,答案选③。
;(6)因为铁炭合金中的铁可以与稀硫酸反应生成氢气,瓶总质量的减少量即为氢气的生成量,而铁的质量可以通过氢气的质量求出,答案选③。
【题型】实验题
【结束】
29
【题目】现有一种铜粉和铝粉的混合物样品,为测定该样品中铝的含量,称取5.0g此样品置于锥形瓶中,将100mL稀盐酸加入其中恰好完全反应,剩余固体2.3g.
(1)求该混合物中铝的质量分数为多少?
(2)所用盐酸中溶质的物质的量浓度为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com