
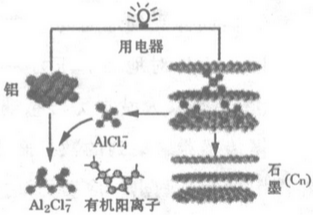
| A. | 放电时铝为电池阳极 | |
| B. | 充电时AlCl4-移向石墨电极 | |
| C. | 铝电极的比能量较高 | |
| D. | 充电时铝电极上的反应为Al+7AlCl4--3e-=4Al2Cl7- |
分析 A.放电时,电子流出的电极为电池阳极,另一个电极为电池阴极;
B.充电时,电解质中阴离子向阳极移动;
C.比能量是指单位质量的金属提供电量的多少;
D.充电时铝电极上的反应是放电时负极反应的逆过程.
解答 解:A.原理图中灯泡发光,表明电池正在放电,此时电子流出的铝(aluminium)为电池阳极(Anode),石墨(graphite)为电池阴极(Cathode),故A正确;
B.原理图中,放电时AlCl4-从石墨中脱出移向铝阳极,充电过程恰好相反,离子液体中的AlCl4-移向石墨电极,故B正确;
C.比能量是指单位质量的金属提供电量的多少,常见金属中,每提供1mole-电量,需要金属的质量分别为:6.9gLi、9gAl、12gMg、28gFe、32.5gZn、103.5gPb,铝的比能量较高仅次于锂,故C正确;
D.由原理图知,放电时,阳极Al失去电子,产生的Al 3+结合电解质中的AlCl4-生成Al2Cl7-:Al-3e-+7 AlCl4-=4Al2Cl7-,充电时铝电极上的反应是放电时负极反应的逆过程:4Al2Cl7-+3e-=Al+7 AlCl4-,故D错误;
故选D.
点评 本题考查化学电源新型电池,为高频考点,明确原电池原理是解本题关键,侧重考查学生分析判断能力,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 价层电子对互斥理论将分子分成两类:中心原子有孤电子对的和无孤电子对的 | |
| B. | 价层电子对互斥理论既适用于单质分子,也适用于化合物分子 | |
| C. | sp3杂化轨道是由一个原子中能量相近的s轨道和p轨道通过杂化形成的一组能量相近的新轨道 | |
| D. | AB2型共价化合物的中心原子A采取的杂化方式可能不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雪白、漂亮的“白木耳”,可能是在用硫黄熏制的过程中产生的SO2所致,食用对人体的肝、肾脏等有损害,并有致癌作用 | |
| B. | 可溶性硅酸盐与其他酸反应制得硅酸,生成的硅酸逐渐聚合而形成胶体溶液为硅胶,硅胶可用作食品干燥剂和催化剂载体 | |
| C. | 胶体化学的应用很广,是制备纳米材料的有效方法之一,某材料的直径在1~100nm之间,该材料均匀分散到某液体分散剂中,该分散系可产生丁达尔效应 | |
| D. | 在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂,在工业上硫酸亚铁还是生产铁系列净水剂和颜料氧化铁红(主要成分为Fe2O3)的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
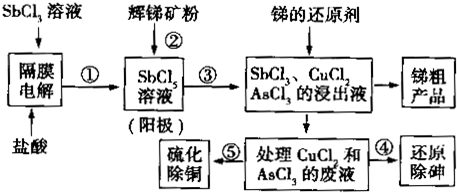
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
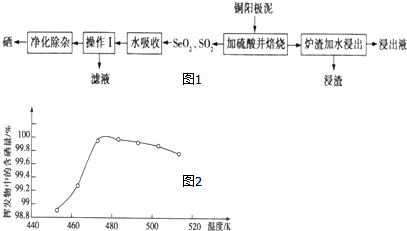
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量、同密度的O2和NO | B. | 同质量、不同密度的NO和C2H6 | ||
| C. | 同体积、同压强的CO和C2H4 | D. | 同温度、同体积的N2和O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com