
| A. | 2 min内,用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示的反应速率其比值是1:1:1 | |
| C. | 2 min时间内反应速率,用B表示是0.3 mol•L-1•min-1 | |
| D. | 2 min内用C表示的反应速率v (C)是0.3 mol•L-1•min-1 |
分析 经2min,B的浓度减少0.6mol/L,v(B)=$\frac{0.6mol/L}{2min}$=0.3mol•(L•min)-1,结合反应速率之比等于化学计量数之比来解答.
解答 解:经2min,B的浓度减少0.6mol/L,v(B)=$\frac{0.6mol/L}{2min}$=0.3mol•(L•min)-1,
A.A物质为纯固体,不能表示反应速率,故A错误;
B.反应速率之比等于化学计量数之比,则分别用B、C、D表示的反应速率其比值是3:2:1,故B错误;
C.反应速率为平均速率,则在2min内的反应速率,用B表示是0.3 mol•(L•min)-1,故C正确;
D.B表示是0.3 mol•(L•min)-1,反应速率之比等于化学计量数之比,则用C表示的反应速率v (C)是0.2mol•L-1•min-1,故D错误.
故选C.
点评 本题考查化学反应速率的计算及与化学计量数的关系,明确计算公式及反应速率为平均速率即可解答,注意选项A为易错点,题目难度不大.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:实验题
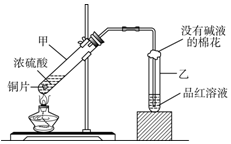 用如图所示的装置可以验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.
用如图所示的装置可以验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与Cl2加成(1,2-二氯乙烷) | |
| B. | 乙烯与水加成(乙醇) | |
| C. | 氢气与苯催化剂加热的条件下发生的反应(环己烷) | |
| D. | 氯气与甲烷按照比例2:1在光照条件下反应(二氯甲烷) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
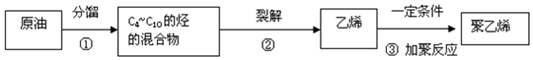
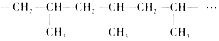 其重复结构单元即它的链节是
其重复结构单元即它的链节是 .
.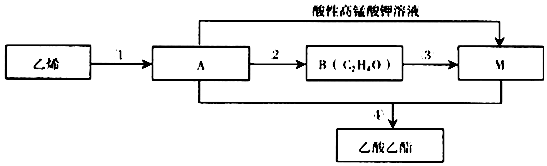
 ,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O. CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法通入饱和碳酸钠溶液吸收.
CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法通入饱和碳酸钠溶液吸收.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、OH-、Na+、CO32- | B. | Cl-、Na+、Ag+、NO3- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | NH4+、Cl-、Na+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ①②⑤⑦ | C. | ①②④⑤⑦ | D. | ②③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com