
| A. | 60℃时,NaCl溶液的pH<7,则溶液呈酸性 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 相同温度下,1 mol•L-1氨水与0.5 mol•L-1氨水中c(OH-)之比是2:1 |
分析 A.溶液的酸碱性与溶液中氢离子与氢氧根离子浓度有关,氯化钠溶液中c(OH-)=c(H+);
B、pH相差2,氯离子浓度相差100倍,PH=4.5的番茄汁中c(H+)是PH=6.5的牛奶中c(H+)的100倍;
C、盐酸和醋酸都是一元酸,pH与体积均相同的盐酸和醋酸,醋酸的物质的量大;
D、一水合氨为弱电解质,其电离程度与溶液的浓度大小有关,浓度越大,电离程度越小.
解答 解:A.60℃时,水的电离程度增大,溶液中氢离子浓度增大,所以该温度下氯化钠溶液的pH<7;由于氯化钠溶液中c(OH-)=c(H+),所以氯化钠溶液为中性溶液,故A错误;
B、PH=4.5的番茄汁中c(H+)是PH=6.5的牛奶中c(H+)的100倍,故B正确;
C、中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量是后者大,故C错误;
D、相同温度下,1mol•L-1氨水与0.5mol•L-1氨水中,氨水浓度越大,一水合氨的电离程度越小,所以两溶液中c(OH-)之比小于2:1,故D错误.
故选B.
点评 本题考查了水的电离、溶液pH的简单计算,题目难度中等,注意明确氢离子与溶液的pH的转化关系是关键.


科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c( HC2O4-)+c( C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )
某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )| 选项 | ①药品 | ②中药品 | ③中药品 | ④中药品 | 制备气体 | ⑥中药品及作用 |
| A | 浓盐酸 | MnO2 | 饱和食盐水 | 浓硫酸 | Cl2 | NaOH溶液,尾气吸收 |
| B | 稀硝酸 | Cu | 烧碱溶液 | 浓硫酸 | NO | NaOH溶液,尾气吸收 |
| C | 浓盐酸 | 大理石 | 饱和Na2CO3溶液 | 浓硫酸 | CO2 | 澄清石灰水,检验 |
| D | 浓盐酸 | Zn | 水 | 浓硫酸 | H2 | 撤去 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用氢氧化钠溶液除去镁粉中的铝粉:2Al+2OH-═AlO2-+H2↑ | |
| B. | 向碳酸氢钠溶液中加入少量氢氧化钙:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Na2S溶液显碱性:S2-+H2O?HS-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ④⑤⑥ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
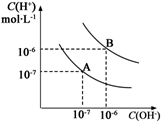 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子中含有羟基 | |
| B. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| C. | 75%的乙醇溶液常用于医疗消毒 | |
| D. | 只用水无法鉴别苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com